§ 49. Назви кислот
У цьому параграфі ви дізнаєтеся:
• що таке кислотоутворюючий елемент;
• як утворюють назви безоксигенових і оксигеновмісних кислот;
Чим відрізняється якісний склад кислот: карбонатної H2CO3 й ортофосфатної H3PO1? Лише одним: елементом, від якого ці кислоти утворилися. Наприклад, для карбонатної та ортофосфатної кислот можна записати такі ланцюжки послідовних перетворень:
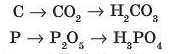
Елементом, який утворює кислоту, — кислотоутворюю-чим елементом — у першому випадку є Карбон, у другому — Фосфор. Саме від їхніх назв і походять корені в назвах кислот — карбонатна H2CO3 й ортофосфатна H3PO1. Отже, назви будь-яких кислот походять від назв відповідних кислотоутво-рюючих елементів:
H2SO1 — сульфатна кислота, HNO3 — нітратна кислота, HNO2 — нітрнтна кислота.
Корені в словах «нітратна» й «нітритна» однакові, тому що вони походять від назви одного й того самого кислотоутворю-ючого елемента — Нітрогену, а суфікси — різні. Чому?
У сполуках HNO3 і HNO2 елемент Нітроген виявляє різну валентність, а різні суфікси в назвах цих кислот відбивають різницю в значенні валентності кислотоутворюючого елемента Нітрогену. Назва кислоти HNO3, у якій Нітроген виявляє найвищу валентність (IV), — нітратна. Кислоту HNO2, у якій значення валентності Нітрогену нижче (III), називають нітратна.
Якими мають бути назви кислот H3PO1 і HPO3, різних за складом, але у яких атом Фосфору виявляє ту саму валентність (V)?
У цьому разі необхідно звернути увагу на число атомів Оксигеиу й Гідрогену в кожній зі сполук. До назви кислоти, яка містить найбільше число атомів цих елементів, додають префікс орто-у а до назви кислоти, що вміщує менше число, — префікс мета-. Наприклад, H3PO1 — ортофосфатиа кислота, HPO3 — лгетафосфатиа кислота.
Збільшення числа атомів Оксигену або Гідрогену в складі ортокислот порівняно з метакислотами зумовлено різницею
числа молекул води у їхньому складі, яку умовно можна записати в такий спосіб:
HPO3 • H2O або H3PO1 — ортофосфатиа,
HBO2 • H2O або H3BO3 — ортоборатиа,
H2SiO3 • H2O або HiSiO1 — ортосилікатна.
Отже, ортокислоти містять у своєму складі більше молекул води, ніж метакислоти.
Назви безоксигенових кислот складають із кореня назви кислотоутворюючого елемента та суфікса -идн чи -ідн і додають слово «кислота». Наприклад, якщо кислотоутворюючим елементом є Хлор або Бром, то назви відповідних кислот такі: HCl — хлорндна кислота, HBr — бромїдна кислота.
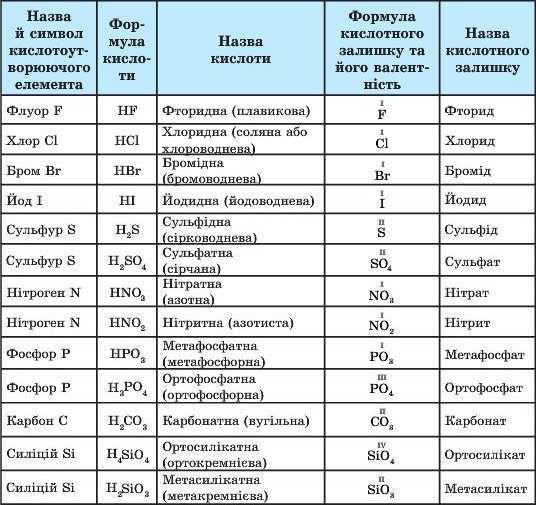
Наведемо формули й назви найпоширеніших кислот та їхніх кислотних залишків за раціональною номенклатурою. У дужках наведено тривіальні назви деяких кислот (табл. 18).
Таблиця 18
Найпоширеніші кислоти
Приклад розв’язування задач
Унаслідок нагрівання карбонатна кислота кількістю речовини 0,075 моль розкладається з виділенням газуватого карбои(ІУ) оксиду. Який об’єм цього газу утвориться за нормальних умов та яку масу натрій гідроксиду необхідно витратити для його поглинання з утворенням солі Na2CO3?

Запитання та завдання
" 1. Який елемент, що входить до складу кислот, називають кислотоутворюючим?
0 2. Як утворюють назви кислот?
3. У яких випадках у назвах кислот, утворених одним і тим самим елементом, застосовують різні суфікси?
4. Чому до назв кислот, утворених одним і тим самим елементом з тією ж валентністю, додають префікси орто- або мета-?
5. Як утворюють назви безоксигенових кислот?
6. Назвіть кислоти: H2SO1, HNO2, H2SiO3, HPO3. Укажіть відповідно валентність елементів Cr, N, Si і P в цих сполуках. Обчисліть масову частку кожного із цих елементів у відповідній кислоті.
Складіть формули кислот, що відповідають цим залишкам, і визначте валентність кислотоутворюючого елемента.
7. Яку назву мають кислотні залишки складу:

* 8. Карбонатна кислота досить легко розкладається навіть за кімнатної температури на газуватий кислотний оксид і воду. Складіть рівняння відповідної реакції та обчисліть об’єм (н. у.) газу, що може виділитися з розчину кислоти, кількість речовини якої складає 0,2 моль.
9. Обчисліть масу нітратної кислоти, необхідної для реакції з магній оксидом масою 5 г.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:12, Переглядів: 5680