§ 29. Йонний зв'язок
У цьому параграфі ви дізнаєтеся:
• який зв'язок називають йонним;
• які елементи утворюють йонні сполуки;
• у яких сполуках існує йонний зв'язок.
Ми розглянули утворення ковалентного зв’язку за умови взаємодії атомів неметалічних елементів. Але в природі існують і випадки взаємодії атомів неметалічних елементів з атомами металічних елементів. Різниця в будові електронних оболонок атомів металічних і неметалічних елементів нолягас в тому, що в атомів металічних елементів на зовнішній електронній обо лонці всього 1-2 (рідко 3) електрони, а в атомів неметалічних елементів — 7, G, 5, 4 електронів (рідко 3). Різна кількість зовнішніх електронів обумовлює і різні механізми утворення металічними та неметялічними елементами стабільної двох або восьмиелектронної конфігурації атомів інертних елементів.
У хімічних реакціях атоми металічних елементів набивають електронної структури інертного елемента, що стоїть перед ними в періодичній системі елементів, за рахунок, від дачі 1, 2 чи 3 електронів із зовнішнього енергетичного рівня. Унаслідок цього вони перетворюються на позитивно заряджені йони катіони, тому що число протонів у ядрі атома перевищує число електронів, які залишилися, на число відданих електронів.
Атоми неметалічних елементів набувають електронної структури того інертного елемента, що стоїть після них у періодичній системі, їм вигідно приєднати 1, 2, 3 чи 4 електрони для завершення зовнішнього енергетичного рівня. У результаті воші перетворюються на негативно заряджені нони — аніони,
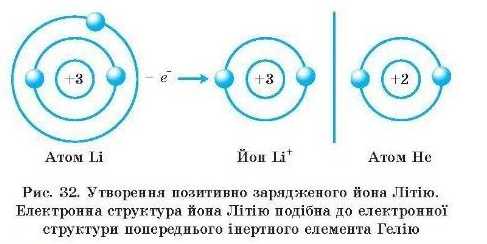
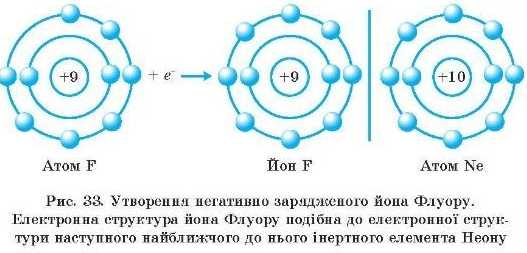
оскільки позитивний заряд ядра атома стає меншим від загального числа електронів па число приєднаних електронів. Заряд йона позначають над його хімічним символом угорі справа: K*, Ala+, Sa", Cl". На рис. 32 і 33 наведено схеми утворення позитивно й негативно заряджених йопів.
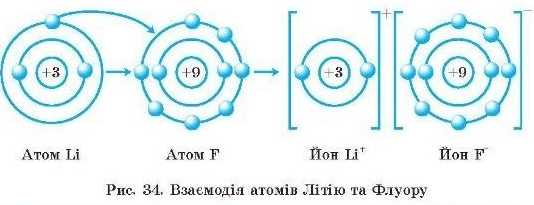
Між різнойменно зарядженими ионами виникає електростатичне притягання, і утворюється сполука з йоиним зв’язком (рис. 34). Електрон переходить від атома Літію до атома Флу ору. Обидва йони — Літію та Флуору — набувають стабільної електронної структури інертних елементів.
Хімічний зв’язок, що утворюється в результаті ел ек т ро ст а тич-
• ♦ «♦« W » "
всі взаємодії протилежно заряджених иошв, називають ион ним, а сполуки, які утворилися внаслідок притягання йовів, називають ііонними.
Слід зазначити, що утворення йонів бінарних сполук можливе тільки в результаті взаємодії атомів металічних і неметалічних елементів. Це пояснюють потребою атомів обох елементів стабілізувати електронну конфігурацію зовнішнього енергетичного рівня. Атоми таких металічних і неметалічних
елементів різко відрізняються один від одного за значеннями електроне гати вністі.
Це, у свою чергу, пов’язано з місцем розташування елемента в періодичній системі. Чим лівіше й нижче розташовані в періодичній системі елементи, тим легше їхні атоми віддають електрони й перетворюються на катіони. І навпаки, чим правіше та вище розташовані у періодичній системі елементи, тим легше їхні атоми приймають електрони й пере творюютьея на аніони.
Прикладами йонннх сполук е натрій хлорид NaCl, калій фторид KF, літій бромід LiBr та інші подібні сполуки лужних металічних елементів з галогенами. За допомогою йоішого зв'язку утворюються і складніші йонні сполуки: основи, солі, які містять складний аніон (ОН-, NOj, SO4", PO4'" тощо).
Наприклад, калій нітрат (калійна селітра) утворюється по зитивпими ионами Калію K+ і негативними ионами кислотною залишку NO:,. Зв’язок між йонями К* і NO" — йонний, а між. атомалш N і О в нітрат йоні NO- — ковалентний полярний.
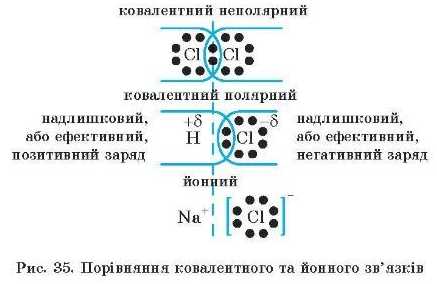
Не слід різко відокремлювати йонний і ковалентний зв’язки один від одного. Ступінь зміщення спільної електронної пари позначають як І 8 або 8 і називають ефективним зарядом*. Якщо порівняти розміщення спільної електронної пари, наприклад, у таких сполуках, як дихлор Clx, гідроген хлорид
I o — ступінь зміщення електронної нари від атома будь якого елемента, якнїі доріїттог уттюрепому штпглідок цього ппдлигпкопому (еф оте ти тшому) ПОЛНТПТІ-ному заряду.
-о - ступінь зміщення електронної пари до атома будь-якого елемента, який дорівнює утвореному внаслідок нього надлишковому (ефективному) негативному заряду.
HCl і натрій хлорид NaCl, то стає очевидним, що йониий зв’язок можна розглядати як граничний випадок ковалентного полярного зв’язку (рис. 35). Унаслідок великої різниці значень електронегативностей взаємодіючих атомів у йонній сполуці спільна електронна пара настільки сильно зміщується в бік атома з більшою електропегативністю, що після цього вона належить тільки йому. Умовно вважають, що зв’язок йонний, якщо різниця електронегативностей двох атомів (Д^) перевищує 1,7.
Цілком йопного зв’язку практично не існує.
Отже, поділ хімічного зв’язку на ковалентний і йонний деякою мірою умовний.
Лабораторний дослід 2. Складання моделей молекул
і кристалів з різними типами хімічного зв’язку
1. Із різнокольорового пласти лі Ity зробіть кульки — моделі атомів Флуору, Оксигену, Нітрогену, Натрію, додержуючись співвідношення їхніх розмірів, наведених на рис. 24.
2. Складіть за рис. 29 кулестрижневі моделі речовин з ковалентним зв’язком: фтору F2 (одинарним), кисню O2 (подвійним), азоту N2 (потрійним), скориставшись сірниками різної довжини для з’єднання кульок.
3. Складіть кулестрижневі моделі молекул складних речовин з полярним ковалентним зв’язком: води H2O (див. рис. до завдання 11 § 28), гідроген хлориду HCL Яку форму мають ці молекули?
4. Складіть кулестрижневу модель речовини з йонпим зв’язком NaCl (рис. 5).
За бажанням можна скласти кульові моделі, у яких кульки стикаються.
Приклади розв’язування задач
Приклад 1. Якою є схема утворення йоііів: а) Натрію; б) Сульфуру?
Розв'язання
1. Спочатку потрібно записати схему будови атома Натрію. При цьому слід пам’ятати, що елемент Натрій має атомний (порядковий) номер 11 у періодичній системі елементів. Отже, заряд ядра його атома +11 і він має стільки ж електронів, але з протилежним знаком. Натрій розташований у третьому періоді, тому 11 електронів цього атома розподіляються по трьох енергетичних рівнях. До того ж Na належить до ІА-групи
форми періодичної системи елементів. Через це на його зовнішньому рівні є тільки один електрон:
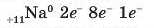
Елемент Сульфур має порядковий номер 16, він також розташований у третьому періоді, але в VIA-групі. Отже, розподіл його 16 електронів по трьох енергетичних рівнях такий:
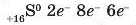
2. В атомі Натрію є один зовнішній електрон. Тому йому енергетично вигідніше віддати цей електрон і мати таку саму стабільну восьмиелектронну конфігурацію зовнішнього енергетичного рівня, як і в атомі найближчого до нього елемента Неону 10Ne, ніж приєднати сім електронів, яких йому не вистачає, щоб утворити зовнішню восьмиелектронну конфігурацію, як в атомі Аргону 18Аг:
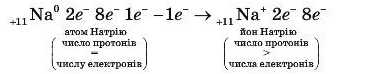
В атомі елемента Сульфуру шість зовнішніх електронів, тому його атому енергетично вигідніше прийняти два електрони й мати таку саму стабільну восьмиелектронну конфігурацію зовнішнього енергетичного рівня, як і в атома найближчого інертного елемента Аргону, ніж віддати шість електронів, щоб мати восьмиелектронну конфігурацію атома досить віддаленого від нього інертного елемента Неону 10Ne:
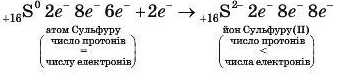

Приклад 2. Якими є схема та рівняння реакції утворення сполуки NaCl? Чи можна її віднести до сполук з йонпим типом зв’язку?
Розв'язання
1. До сполук з йонпим типом зв’язку відносять сполуки, у яких різниця електронегативиостей атомів, що утворили зв’язок, перебуває приблизно в межах від 1,70 до 3,24. Зазначимо, що сполук зі 100 %-вим йонпим зв’язком не існує, бо в такому разі ця різниця дорівнювала б 4,0, тобто електронега-тивпості атома Флуору. Але електронєгативність пайтиповіших металічних елементів Цезію Cs і Францію Fr більша за пуль і сягає 0,75. Знаходимо різницю електронегативиостей:
АХ (Cs-F) = х (F) - X (Cs) = 4,0 - 0,75 = 3,25.
Отже, йонність хімічного зв’язку тим більша, чим більш типовий металічний елемент реагує з більш типовим неметаліч-ним елементом. Наприклад, у такій сполуці, як CsF, зв’язок на 89 % йонний і на 11 % ковалентний. У такому разі слід уважати, що це сполука з переважно йонним типом зв'язку.
Визначаємо різницю електронегативиостей атомів, що утворили сполуку NaCl:
АХ (Na-Cl) = х (Cl) - х (Na) = 3,0 - 0,93 = 2,07.
Її значення свідчить про те, що NaCl можна віднести до сполук із переважно йонпим типом хімічного зв’язку.
Якщо електрони умовно позначити як е , то схему утворення сполуки NaCl з атомів Натрію і Хлору можна подати таким чином:
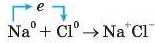
Але спочатку молекула хлору Cl2 в процесі реакції розпадеться на атоми Хлору СІ. Тому в загальному випадку рівняння реакції утворення сполуки NaCl має такий вигляд:
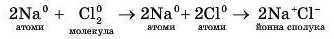
Запитання та завдання
1. До металічних елементів відносять ті, що на зовнішньому енергетичному рівні мають: а) 7, б, 5 (рідко 4) електронів; б) 1-2 (рідко 3) електрони.
'2. У чому полягає відмінність утворення стабільної двох-або восьмиелектронпої конфігурації атомів інертних елементів: а) атомами металічних елементів; б) атомами не-металічних елементів?
3. Які частинки називають йопами?
°4. Випишіть з наведеного нижче переліку окремо: а) атоми; б) катіони; в) аніони; г) молекули.
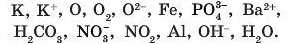
5. Який зв’язок називають йонним? Наведіть приклади сполук із переважно йонним типом зв’язку.
°6. Чим зумовлений зв’язок між йопами в йоиній сполуці?
°7. Утворення йонпого зв’язку можливе за рахунок взаємодії атомів лише: а) металічних елементів; б) металічних і неметалічних елементів; в) пеметалічних елементів. Виберіть правильне твердження.
8. Чому не слід відокремлювати йонний і ковалентний зв’язки один від одного?
9. Виберіть формули сполук, у яких хімічні зв’язки: а) ковалентні полярні; б) ковалентні неполярні; в) йонні.
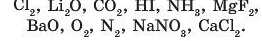
10. У чому полягає подібність електронної будови йопів K , Ca2+, Cl , S2^ до електронної будови атома Аргону?
11. Якими є схеми й рівняння реакцій утворення сполук: а) берилію з киснем; б) магнію з фтором?
Чи можна віднести їх до сполук з переважно йонпим типом зв’язку й за яким критерієм?
12. Які з елементів Cs, Ca, Р, S, Sr, F спроможні утворювати катіони, а які — аніони? У результаті взаємодії яких пар елементів це можливо? Якими є схеми утворення цих йонів?
*13. Який з атомів — Mg чи Ca — легше перетворюється на катіон, а який з атомів — F чи S — па аніон? За яким критерієм це можна розпізнати?
*14. Йон якого елемента має на 4 протони й 8 електропів більше, ніж йон Магнію? Яка масова частка (%) Магнію в сполуці із цим елементом?
*15. Які зв’язки в кальцій карбонаті CaCO3 йонпі, а які — ковалентні?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:59, Переглядів: 4792