§ 20. Йонний зв'язок
Пригадайте, лужні елементи — це елементи IA групи, галогени — елементи VIIA групи.
Утворення речовин з йонним зв'язком
Механізм утворення речовин з йонним зв’язком має спільні риси з утворенням речовин з ковалентним зв’язком. Вони так само утворюються завдяки перерозподілу електронів. Йонний зв’язок існує в речовинах, утворених металічними та неметалічними елементами.
Атоми металічних елементів втрачають електрони, перетворюючись на позитивно заряджені йони (катіони), а атоми неметалічних — приймають електрони, перетворюючись на негативно заряджені йони (аніони). Між цими різнойменно зарядженими йонами виникає електростатичне притягання, сила якого залежить від зарядів йонів та їхніх радіусів. Такий зв’язок називають іонним.
Хімічний зв'язок, що виникає в результаті притягання протилежно заряджених йонів, називають йонним.
При хімічній взаємодії натрію та хлору утворюються йони Натрію Naf та хлорид-іони СГ (мал. 20.1):
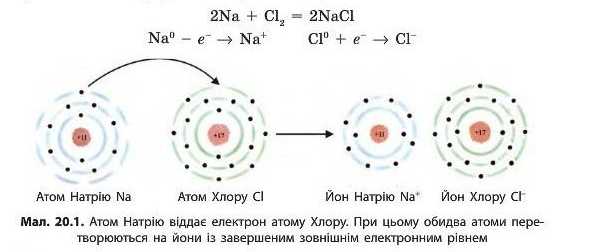
Продукт взаємодії — натрій хлорид — цілком складається з йонів Натрію та хлорид-іонів, утворених переміщенням електронів від атомів Натрію до атомів Хлору. Йони в кристалі між собою не зв’язані жорстко, тобто між ними не існує спільних електронних пар. У натрій хлориді вони утримуються разом завдяки притяганню між протилежно зарядженими йонами (мал. 20.2).

Йонний зв’язок характерний для
основних оксидів (Na2O, MgO), лугів (Na1OH-, K+OH) та солей (NaiCl-, K1NOa).
Катіони й аніони можуть складатися не тільки з одного, але й з декількох атомів. Наприклад, луги утворені катіонами металів М* і гідроксид-іонами OH . і Зв'язок між катіонами металічних елементів М" і гідроксид-іонами OH йонний, а між атомами Гідрогену й Оксигену в йоні OH — ковалентний полярний.
— ______ — _ __ _ — ______ —
Критерій утворення йонного зв'язку
Утворення речовин з йонним зв’язком можна розглядати і з погляду утворення спільної електронної пари:
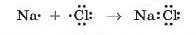
Але Натрій і Хлор значно відрізняються за електронегативністю і атом Хлору настільки сильніше притягував би спільну електронну пару, що вона повністю перейшла б до нього, а атому Натрію вже не належала б. Тому електрон, що перебував на зовнішньому рівні атома Натрію і мав утворити спільну електронну пару, одразу переходить у повну власність атома Хлору з одночасним перетворенням цих атомів на йони.
Отже, йонний зв’язок можна розглядати як крайній випадок ковалентного полярного зв'язку, коли спільна електронна пара повністю перейшла до одного з атомів. Йонний зв’язок існує між атомами елементів зі значною різницею між значеннями їх електро-негативностей.
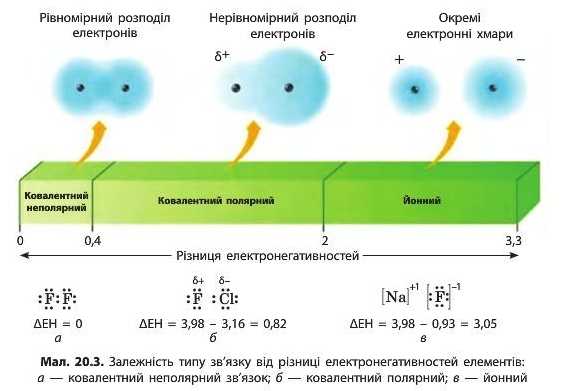
Умовно вважають, що зв’язок є йонним, якщо різниця елек-тронегативностей двох елементів (ΔΕΗ) перевищує 2 (мал. 20.Зв). Якщо ж різниця між електронегативностями елементів менша за 2, то зв’язок вважається ковалентним полярним (мал. 20.3б). Між атомами одного неметалічного елемента, звичайно, існує ковалентний неполярний зв’язок (мал. 20.3а) . Але іноді неполярним вважають зв’язок між атомами різних неметалічних елементів за умови, що ΔΕΗ не перевищує 0,4.
Лінгвістична задача
У перекладі з грецької кота означає вниз, під, проти, ано — догори, вверх, назад, еімі — йти. Як на вашу думку, що означають терміни «катіон» та «аніон»?
Висновки
1. Йонний зв'язок існує в речовинах, утворених елементами зі значною різницею електронегативностей. При взаємодії речовин, утворених такими елементами, відбувається повна передача електронів від
атомів металічних елементів до атомів неметалічних елементів з утворенням протилежно заряджених йонів.
2. Речовини з йонним зв'язком існують у вигляді кристалів, у яких позитивно заряджені йони оточені певним числом негативно заряджених йонів і навпаки. Йонний зв'язок реалізується завдяки електростатичному притяганню протилежно заряджених йонів.
Контрольні запитання
1. Який зв'язок називають йонним? Наведіть приклади сполук з йонним зв'язком.
2. За якою ознакою можна відрізнити йонний зв'язок від ковалентного полярного?
3. Сформулюйте дві відмінності йонного зв’язку від ковалентного.
Завдання для засвоєння матеріалу
1. Чим принципово відрізняється ковалентний зв'язок від йонного?
2. Наведіть по дві формули сполук, у яких Оксиген утворює зв'язок:
а) йонний; 6) ковалентний.
3. Випишіть з поданого переліку в окремі стовпчики формули сполук, у яких хімічний зв'язок: а) ковалентний неполярний; 6) ковалентний полярний; в) йонний. Hy HBr, Na2O, CaO, CO2, CO, O2, NO2, K3N, NH3, N2, NF3, F2, OF2, MgF2.
4. Зобразіть схему утворення йонів на прикладі: а) калій флуориду KF;
б) магній оксиду; в) алюміній броміду AIBrj.
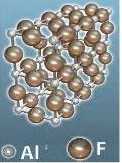
5. На малюнку зображена модель кристалу алюміній флуориду. Визначте, скільки йонів оточує кожний йон Алюмінію та йон Флуору.
б*. Поняття «валентність» не коректно застосовувати для елементів у складі йонних сполук. Як ви вважаєте, які принципові відмінності речовин з ковалентним та йонним зв'язком зумовлюють таку некоректність?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:58, Переглядів: 6012