§ 15. Йонний зв’язок, його утворення
Опанувавши матеріал параграфа, ви зможете:
• розрізняти атоми та йони; позитивно й негативно наряджені йоии; речовини н ковалентним і йонпим зв’язками;
• розуміти механізм утворення позитивно й негативно заряджених йоиів; суть утворення йоішого зв’язку; поняття «йоинна сполука»;
• наводити приклади сполук із йонпим зв’язком;
• характеризувати особливості йоішого зв’язку.
Ви розглянули утворення хімічного зв’язку, що виникає між атомами неметалічних елементів. Але існують сполуки, до складу яких входять атоми металічних і неметалічних елементів. Такі сполуки належать до йоиних.
Отже, і зв’язок між частинками — йоиний.
Йони. Під час взаємодії металів з неметалами атоми елементів перетворюються на йони.
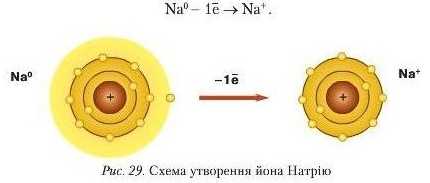
Розглянемо механізм утворення йонів Натрію та Хлору. Звернемося до будови атома Натрію. Із його електронної формули 1 л*22.V22/763.v1 видно, що на зовнішньому енергетичному рівні рухається один .v-електрон. До завершення енергетичного рівня бракує сім електронів. Тому атому Натрію енергетично легше віддати один .v-електрон. ніж приєднати сім. Віддаючи електрон, атом повністю втрачає цей рівень, а попередній є завершений.
Схематично цей процес зображено на рисунку 29, але його можна подати й так:
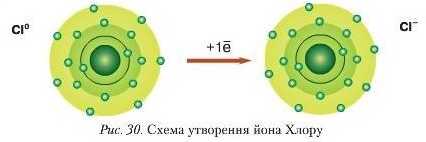
В атома Хлору па зовнішньому енергетичному рівні розташовуються сім електронів. Його електронна формула — l.v22.v22/A3.s23//\ І до завершення енергетичного рівня бракує одного електрона. Тому атому Хлору енергетично вигідніше приєднати один електрон, ніж віддати сім (рис. ЗО).
Це перетворення можемо написати й так:
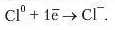
Втрачаючи 1 електрон із зовнішнього енергетичного рівня, атом HarIpiio перетворюється на позитивно заряджений йоп Нагрію Na* (катіон Нагрію). Атом Хлору, приєднуючи 1 електрон, утворює негативно заряджений йоп Хлору Cl (аніон Хлору). Отже, під час взаємодії натрію з хлором валентний електрон атома Натрію переходить на зовнішній енергетичний рівень атома Хлору з утворенням різнойменно заряджених частинок.
Йони заряджені частинки, на які перетворюються атоми або групи атомів, коли вони втрачають або приєднують електрони.
Позитивно заряджені йони називають катіонами, а негативно заряджені аніонами.
Величина заряду попа залежить від кількості відданих або прийнятих електронів. Наприклад, віддаючи 2 електрони, атом Кальцію Ca" перетвориться па катіон Кальцію з зарядом 2+ Ca2 . Якщо атом Нітрогену приєднає 3 електрони, то перетвориться па йоп Нітрогену з зарядом 3” Ns-. Зверніть увагу: заряд йона проставляють біля символу елемента вгорі праворуч, записуючи спочатку чисельне значення, а потім знаки «+» (для катіона) або (для аніона).
Утворення йонного зв’язку. З курсу фізики вам відомо, що протилежно заряджені частинки мають здатність притягуватися. Тому різнойменно заряджені йоии Натрію та Хлору притягуються за рахунок електростатичних сил притягання, утворюючи йонну сполуку — кристал (рис. 31).
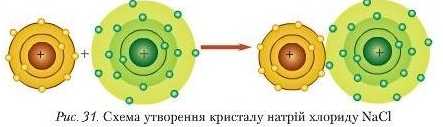
За допомогою хімічних символів цю схему можна записати так:
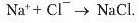
Атоми й утворені ними йоии відрізняються між собою за:
а) числом енергетичних рівнів (йоии металічних елементів);
б) розмірами частинок (радіусами);
в) наявністю зарядів у йоиів;
г) властивостями.
Властивості атомів та йоиів різні, бо вони відрізняються за будовою.
Поясніть на конкретному прикладі, чим відрізняються йони: а) позитивно заряджений; б) негативно заряджений від відповідних їм атомів.
Поняття «молекула» для таких сполук — умовне. Здебіл ьиюго вживається поняття «формульна одиниця». Вона вказує на співвідношення йоиів у сполуці.
У рівняннях реакцій перехід електронів позначають стрілкою, що відходить від атома, який віддає електрони, до атома, що їх приєднує. Наприклад, утворення кристалу кухонної солі можна подати таким рівнянням:
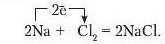
Хімічний зв’язок між йоиами називають йоиним.
З нього випливає, що в йоішій сполуці є однакове число позитивних і негативних нарядів. Це означає, що сполуки, утворені нонами, — електронейтральні.
Порівнявши йониий зв'язок із ковалентним полярним, можна зробити висновок про те, що йонпий зв'язок є крайнім випадком полярного ковалентного.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Йони — заряджені частинки, в які перетворюються атоми або групи атомів, коли вони втрачають або приєднують електрони. Позитивно заряджені йони називаються катіонами, а негативно заряджені — аніонами.
• Хімічний зв’язок між йонами називається йонним.
• Атоми й утворені ними йони відрізняються між собою за: а) числом енергетичних рівнів (йони металічних елементів); б) розмірами частинок (радіусами); в) наявністю зарядів у йонів; г) властивостями.
• У йонній сполуці є однакове число позитивних і негативних зарядів. Сполуки, утворені йонами, — електронейтральні.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Сформулюйте визначення: а) йонів; б) йонного зв’язку.
2. Поясніть, яким чином утворюються позитивно й негативно заряджені йони.
3. Поясніть відмінність між атомами й відповідними їм йонами.
4. Класифікуйте речовини, подані формулами, за типом хімічного зв'язку: N2, CaCI2, KF, O3, H2O1 AIBr3, NH3, H2, SiH4.
5. Поясніть записи: a) Ca - 2е -> Ca2*; б) Br + 1е -> Br".
6. Напишіть рівняння реакції між попарно взятими речовинами:
а) літієм і сіркою; б) сіркою і киснем; в) магнієм і хлором та вкажіть, де це можливо, перехід електронів.
• Йони використовують для очистки води на великих водоочисних станціях та в домашніх умовах. У фільтри вміщують пористий іонообмінний елемент, що очищає воду від катіонів Кальцію Ca2* та Магнію Mg2*, нафтопродуктів, хлору чи іржі. Додавання катіонів Аргентуму Ag* дає змогу ефективно боротися з мікробами.
• Йони F", СГ, Br, Г є мікроелементами, що життєво необхідні людині для нормального функціонування організму. Йони Флуору
беруть участь у процесах розвитку та нормального росту зубів й кісток, а також тканин ендодерми: епідермісу, волосся, нігтів. Йони Хлору регулюють водний баланс; йони Брому впливають на нервову систему; йони Іоду регулюють усі обмінні процеси в організмі, підтримують водно-сольову рівновагу, запобігають захворюванню на зоб, глухоті, паралічу, слабоумству.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:57, Переглядів: 3233