§ 32. Валентність атомів елементів з точки зору електронних структур атомів та утворення хімічних зв'язків
У цьому параграфі ви дізнаєтеся:
• за яких умов виникають хімічні зв'язки;
• ідо таке валентність атомів з точки зору їхньої спроможності утворювати хімічні зв'язки;
• який стан атома називають збудженим і з яких причин атоми переходять у цей стан.
Ha сьогодні відкрито вже 118 елементів, а число простих і складних речовин, утворених цими елементами, перевищує 20 мли. Таку невідповідність пояснюють спроможністю атомів різних елементів у процесі взаємодії сполучатися між собою за допомогою валентних електронів, тобто електронів, які беруть участь в утворенні хімічних зв’язків. Вам уже відомо, що число хімічних зв’язків визначається числом спільних електронних пар. Число ж останніх дорівнює числу неспареиих електронів на зовнішньому енергетичному рівні
атома. Так, в атомі Флуору є один неспареиий електрон, який утворює тільки один хімічний зв’язок (одну спільну електронну пару) H—F. В атомі Нітрогену наявні три неспа-рених електрони, тому він утворює відповідно три хімічних зв’язки (три спільні електронні пари) N=N. Такі спільні електронні пари характерні лише для ковалентного зв’язку, через це про валентність атомів можна говорити лише у випадку ковалентних сполук.
У речовинах з йонним зв’язком спільні електронні пари відсутні, тому для таких речовин поняття валентності як числа хімічних зв’язків не має змісту.
Валентні можливості атомів елементів (їхня спроможність утворювати хімічні зв’язки) визначаються передусім числом иеспарених електронів. Розглянемо це на прикладі атомів таких елементів, як Бор, Силіцій і Фосфор. Для цього зобразимо схеми зовнішніх електронних структур їхніх атомів:
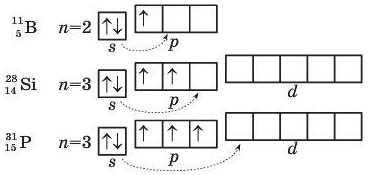
Аналіз цих структур показує, що в атомі Бору на зовнішньому енергетичному рівні є один неспарений р-електрон: він визначає валентність атома Бору, що дорівнює одиниці. Проте стійких сполук цього елемента з валентністю І поки що не одержано. Але за певної затрати енергії ззовні, наприклад у разі нагрівання, спарені електрони 2.9-підрівня можуть розпаровуватися. Атом переходить у збуджений стан, у результаті якого всі три електрони зовнішнього рівня стають неспареии-ми. За рахунок трьох иеспарених електронів атома Бору в збудженому стані утворюються сполуки B2O3, BCl3 тощо.
У збуджений стан, як видно зі схем, можна перевести й атоми елементів третього періоду (за винятком атомів Натрію та інертного елемента Аргону). І тоді, наприклад, атом Силіцію буде виявляти валентність, яка дорівнює IV, а атом Фосфору — V.
Не всі елементи спроможні підвищувати валентність у вказаний спосіб. Так, наприклад, в атомів Нітрогену, Оксигену й Флуору немає вільних орбіталей, усі їхні 2s- і 2р-орбіталі
зайняті електронами, а d-підрівепь в атомів другого періоду відсутній (див. табл. 9).
Валентність атомів виявляється тільки в процесі взаємодії, наслідком якої є утворення ними хімічного зв’язку. У результаті цього суттєво перебудовуються електронні структури атомів, що взаємодіють, а отже, змінюються їхні валентність і властивості в сполуках.
Як наочного зобразити поняття валентності? Електрони, що перебувають на зовнішньому енергетичному рівні, позначають точками навколо хімічного символу елемента. Спільні для двох атомів електрони (тобто ті, що беруть участь в утворенні ковалентного зв’язку) зображують точками між їхніми хімічними символами. Подвійний і потрійний зв’язок позначають відповідно двома або трьома парами спільних точок. Наприклад, утворення молекул H2, N2, H2O, CO2 можна подати таким чином:
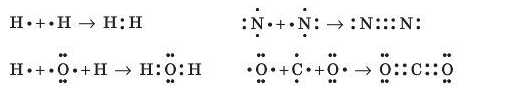
У наведених схемах подано електрони лише зовнішніх енергетичних рівнів атомів елементів, тому що тільки вони можуть брати участь в утворенні ковалентного типу хімічного зв’язку.
Із цих схем випливає, що в молекулі водню кожний з атомів Гідрогену отримує стійку двоелектронну оболонку, а в молекулі азоту атоми Нітрогену — стійку восьмиелектроину оболонку. Таке саме можна констатувати відносно атомів Оксигену в молекулах води та атомів Карбону й Оксигену в молекулі карбон(ГУ) оксиду.
Якщо в наведених схемах кожну загальну пару електронів позначити однією рискою, то утворення ковалентного зв’язку можна зобразити у вигляді таких структурних формул:
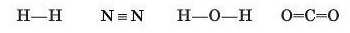
1. Що таке валентність елементів? Яким чином можна збільшити валентні спроможності їхніх атомів? Якими прикладами це можна підтвердити?
2. Дайте визначення хімічного зв’язку. Між якими атомами та за яких умов вій може утворитися?
3. Поняття валентність можна застосувати: а) тільки до сполук з ковалентним хімічним зв’язком; б) тільки до сполук з йонним хімічним зв’язком; в) як до сполук з ковалентним, так і до сполук з йонним хімічним зв’язком.
4. Участь в утворенні спільних електронних пар можуть брати електрони тільки: а) з протилежно направленими спінами; б) з однаково направленими спінами. Виберіть правильну відповідь і поясніть її.
5. Чим можна пояснити прагнення атомів до утворення ковалентного зв’язку? Це можуть бути атоми: а) тільки металічних елементів; б) тільки неметалічних елементів; в) як металічних, так і неметалічних елементів.
6. Який ковалентний зв’язок міцніший: а) одинарний; б) подвійний; в) потрійний?
7. Складіть схеми електронної будови атомів Хлору й Окси-гену. Визначте валентність цих елементів у сполуках Cl2O7, НСЮ, HClO2, HClO3, HClO1, Cl2O і поясніть можливість її виявлення.
8. За структурною формулою визначте валентності елементів у молекулі дисульфатної кислоти:
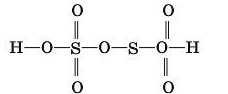
9. Визначте валентність Фосфору в наведених сполуках за їхніми структурними формулами:
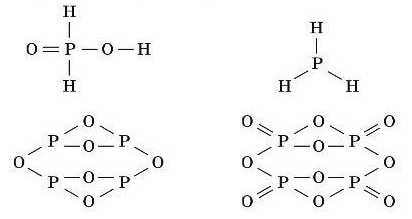
IO Яка валентність характерна для атомів Флуору, Сульфуру й Хлору з урахуванням можливого розпарювання електронів зовнішнього енергетичного рівня в процесі утворення сполук?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:03, Переглядів: 2530