§ 31. Генетичний зв'язок між класами неорганічних сполук
— Що таке «генетичний»?
— «Генезис» грецькою означає «походження». Тобто ця назва говорить про те, що з одних речовин можна одержати інші.
— Зрозуміло. Hy так цим, власне, хіміки й займаються: одержують нові речовини з відомих.
Між класами неорганічних сполук існує зв’язок, який називають генетичним. Цей зв’язок полягає в тому, що з речовин одного класу можна одержати речовини інших класів.
Існує два основних шляхи генетичних зв’язків між речовинами: один із них починається металами, інший — неметалами.
Наприклад, кальцій сульфат CaSO1 можна одержати таким чином:
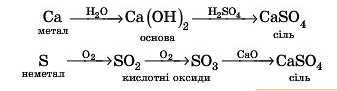
Завдання
Запропонуйте · хід практичної роботи за схемою (2).
Напишіть рівняння відповідних реакцій.
Завдання
Напишіть рівняння реакцій, які відповідають перетворенню (3).
Завдання
Запропонуйте хід практичної роботи за схемою (3). Напишіть рівняння відповідних реакцій. Яр: ви визначите, що одержали кислоту?
Завдання
Напишіть рівняння реакцій, які відповідають перетворенню (4). Запропонуйте спосіб видалення силікатної кислоти в чистому вигляді з отриманої суміші.
Одночасно існують також інші способи взаємоперетворень сполук різних класів. Таким чином, генетичні зв’язки між різними класами сполук дуже різноманітні.
Основними є такі генетичні лінії:
1) Метал -» основний оксид —» луг —»
—» сіль,
Наприклад, генетичний ряд калію:
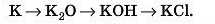
2) Метал основний оксид —» сіль —» —» нерозчинна основа —» основний оксид —» метал.
Наприклад:
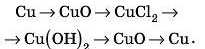
3) Неметал —» кислотний оксид -* розчинна кислота —> сіль.
Наприклад:
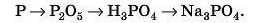
4) Неметал —» кислотний оксид —» —» сіль -» кислота —> кислотний оксид —> неметал.
Напоиклал:
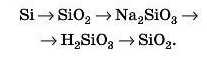
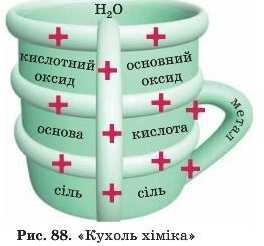
Пропонуємо схеми, які, можливо, допоможуть вам під час складання рівнянь.
Перша дуже стара, має назву «Кухоль хіміка». Тут усі суміжні речовини реагують одна з одною:
Інша схема більш сучасна:
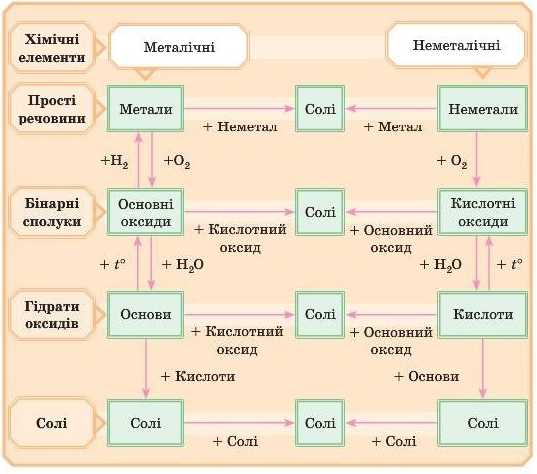
Спробуйте написати рівняння всіх реакцій за цією схемою. Якщо ви успішно виконаєте завдання, це означає, що навчальний матеріал знаєте відмінно!
ВИКОНАЙТЕ ЗАВДАННЯ
1. Напишіть рівняння реакцій, які відповідають перетворенням:
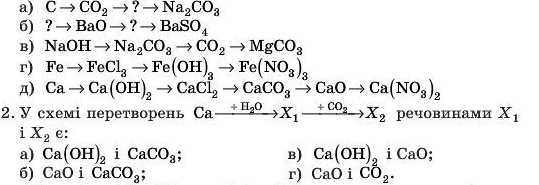
Обчисліть об’єм CO2, необхідний для проведення другої реакції (н. у.), якщо маса кальцію, що прореагував, дорівнює 10 г.
3. У схемі перетворень P —» X —» Ca3 (PO4) речовиною X є:
а) PH3; в) P2O3;
б) Ca3P2; г) P2O5.
4. Який об’єм водню (н. у.) утвориться внаслідок дії води на сплав, який містить 4,6 г натрію й 3,9 г калію?
5. Протягом року людина вживає в їжу близько 6 кг кухонної солі. Яка кількість речовини Натрію міститься в цій масі солі?
6. У надлишку розчину сульфатної кислоти розчинили магній масою 6 г і залізо масою 16,8 г. Який об’єм водню, виміряний за и. у., виділився при цьому?
7. Визначте об’єм кисню (н. у.), потрібний для спалювання 12 г вугілля, яке містить 12 г карбону, з утворенням вуглекислого газу. Яка маса кальцій гідроксиду знадобиться, щоби поглинути весь утворений карбон(ІУ) оксид? (Припустіть, що утворюється тільки середня сіль.)
ДЛЯ допитливих
1. Мідний купорос обробили розчином соди. Осад прожарили. Отриманий після цього чорний порошок нагріли з вугіллям. Напишіть рівняння реакцій, які при цьому відбувалися.
2. Є шматочок мідного дроту. Як із допомогою хімічних реакцій перетворити його на тонкий мідний порошок? Напишіть рівняння реакцій.
3. Ферум(ІІ) сульфат, який міститься в мінеральній воді, можна видалити з неї з допомогою вапна. Обговоріть використання в цьому випадку гашеного й негашеного ванна. Складіть рівняння реакцій, які відбуваються при цьому.
4. Покажіть із допомогою рівнянь реакцій, як, маючи у своєму розпорядженні мідний купорос та інші необхідні реактиви: а) одержати блакитний осад; б) перетворити блакитний осад на чорний, а із останнього одержати синій розчин; в) із чорного осаду одержати червону мідь; г) із синього розчину виділити червону мідь. Спробуйте виконати ці перетворення в шкільній лабораторії.
δ. Із руд, які містять мідь у вигляді купрум(І) сульфіду Cu2S, мідь виплавляли так: а) руду випалювали за доступу повітря до перетворення купрум(І) сульфіду на купрум(І) оксид; б) випалену руду' змішували з удвічі меншою кількістю невипаленої, суміш прожарювали без доступу повітря. Напишіть рівняння реакцій, у результаті яких утворювалася мідь, урахувавши, що сірка переходить у сульфур(ІУ) оксид.
6. Гранули натрій гідроксиду' під час зберігання на повітрі поступово розпливаються, але із часом ніби «висихають», перетворюючись на білий порошок. Поясніть ці явища, напишіть рівняння реакцій.
7. Суміш кальцій карбонату й натрій сульфату обробили надлишком хлоридної кислоти, випарили досуха й додали трохи води. Які тепер речовини містяться в осаді, а які — в розчині? Відповідь підтвердьте рівняннями реакцій.
8. Речовина А, з’єднуючись із водою, утворює речовину В, яка забарвлює фенолфталеїн у малиновий колір. Речовина В реагує із сульфатною кислотою з утворенням солі, яка забарвлює полум’я в жовтий колір. Назвіть речовини А, Б, В і напишіть рівняння згаданих тут реакцій.
9. Учневі запропоновано чотири зразки твердих речовин: соду (натрій карбонат), крейду, натрій сульфат і гіпс (основна частина — кальцій сульфат). Чи можна розпізнати ці речовини, маючи воду й нітратну кислоту? Відповідь обґрунтуйте.
10. Маючи у своєму розпорядженні лише воду, крейду, кухонну сіль та продукти їх реакцій, отримайте не менш ніж 10 різних неорганічних сполук (вибір процесів необмежений).
11. Є п’ять пробірок, які містять розчини хлоридної кислоти, кальцій хлориду, арґентум нітрату, калій карбонату й натрій гідроксиду. Як, не використовуючи інших реактивів, з’ясувати, в якій пробірці міститься кожна речовина?
12. До складу свинцевих білил, які використовують у живопису, входить плюмбум гідроксокарбонат Pb8 (OH)2 (CO8 )2. З часом під дією гідроген сульфіду, який міститься в повітрі, він темнішає, перетворюючись на плюмбум сульфід. Напишіть рівняння цієї реакції. Запропонуйте хімічну реакцію, з допомогою якої можна «поновити» картину, усунувши чорний плюмбум сульфід.
13. В епсомської солі багато імен: англійська сіль, гірка сіль, епсо-лій, зиландит, магнезія сірчанокисла, рейхардит, магній сульфат. Гіркота морської води пояснюється наявністю цієї солі, медики її використовують як сольове проносне в разі отруєнь. Напишіть п’ять-шість рівнянь реакцій одержання цієї солі.
ДОМАШНІ ЕКСПЕРИМЕНТИ
(Просимо допомоги батьків!)
Перед виконанням експерименту треба підготувати собі на кросні робоче місце, надіти спеціальний одяг, заслати стіл клейонкою. Під час досліду слід користуватися спеціальним посудом і обладнанням. Після закінчення роботи все прибрати та помити руки.
1. Розпізнаємо сіль «Екстра» й питну соду
Попросіть батьків потай від вас насипати по одній чайній ложці солі «Екстра» й питної соди в одноразові стаканчики й підписати їх маркером: № 1, № 2. З’ясуйте, де міститься сіль, а де питна сода. Продумайте хід експерименту. Розпізнайте білі речовини. Стисло опишіть хід експерименту. Правильність визначення речовин перевіряють батьки.
2. Виводимо шахраїв на чисту воду
Раніше в поїздах чай заварювали в каструлі й розливали пасажирам. Іноді нечесні провідники, щоб візуально зробити чорний чай більш насиченим, додавали в нього питну соду. Але перевіряючі дуже легко виводили шахраїв на чисту воду. А чи зможете ви так само легко це зробити?
Попросіть батьків (або друга) перед дослідом приготувати два напої: чорний чай і фальсифікований чорний чай. Нехай вони наллють ці напої в одноразові стаканчики й підпишуть їх маркером: № 1, № 2.
Продумайте хід експерименту і з’ясуйте, де міститься фальсифікований чорний чай. Стисло опишіть хід експерименту. Правильність визначення перевіряють батьки.
ДОДАТКИ
Орієнтовні завдання для практичних робіт
ПРАКТИЧНА РОБОТА № 1 «ДОСЛІДЖЕННЯ ВЛАСТИВОСТЕЙ ОСНОВНИХ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК»
Перед початком практичної роботи вчитель обов'язково проводить інструктаж з техніки безпеки роботи з хімічними речовинами й обладнанням, докладно розбирає хід роботи.
1. Дослідження взаємодії кислот з металами
• У 2 пробірки налийте розчин хлоридної (або іншої) кислоти та додайте: у першу — скріпку або стальну дротинку (гранулу цинку), у другу — мідну дротинку.
• Опишіть ваші спостереження, запишіть рівняння хімічної реакції.
• Поясніть результати досліду.
2. Дослідження взаємодії основного оксиду з кислотою
• У пробірку насипте трохи купрум(ІІ) оксиду й долийте розчин хлоридної (або іншої) кислоти. Для прискорення реакції пробірку з умістом нагрійте.
• Опишіть ваші спостереження, запишіть рівняння хімічної реакції.
• Поясніть результати досліду.
3. Одержання нерозчинної основи
• Налийте в пробірку розчин мідного купоросу (купрум(ІІ) сульфату) і додайте розчин лугу. Розділіть отриманий куирум(ІІ) гідроксид на 2 пробірки для подальших дослідів.
• Опишіть ваші спостереження, запишіть рівняння хімічної реакції.
• Поясніть результати досліду.
4. Реакція взаємодії кислот з основами
а) У пробірку налийте розчин лугу, наприклад натрій гідроксиду, та додайте 2-4 краплі фенолфталеїну.
До утвореного розчину долийте розчин хлоридної кислоти.
Опишіть ваші спостереження, залишіть рівняння хімічної реакції. Поясніть результати досліду, б) В одну з пробірок з отриманим кунрум(ІІ) гідроксидом із досліду № 3 додайте розчин кислоти.
Опишіть ваші спостереження, запишіть рівняння хімічної реакції.
Зробіть висновок про взаємодію кислот з розчинними й нерозчинними основами.
5. Розкладання нерозчинних основ під час нагрівання
• Другу пробірку з купрум(ІІ) гідроксидом (із досліду № 3) нагрійте.
• Опишіть ваші спостереження, запишіть рівняння хімічної реакції.
• Поясніть результати досліду.
6. Взаємодія кислот із солями
• У пробірку налийте розчин соди (харчової NaHCO3 або кальцинованої Na2CO3) і додайте розчин кислоти.
• Опишіть ваші спостереження, запишіть рівняння хімічної реакції.
• Поясніть результати досліду.
ПРАКТИЧНА РОБОТА № 2
«РОЗВ'ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ» 14
• Запишіть рівняння реакцій.
• Поясніть хід розв’язання задачі.
4. Отримання солей
• Із натрій сульфату одержіть натрій нітрат.
• Запишіть рівняння реакції.
• Поясніть хід розв’язання задачі.
5. Перетворення оксиду на гідроксид
• Із купрум(ІІ) оксиду одержіть кунрум(И) гідроксид.
• Запишіть рівняння реакцій.
• Поясніть хід розв’язання задачі.
6. Практичні перетворення за схемою
• Здійсніть практично перетворення за схемою:

• Запишіть рівняння реакцій.
• Поясніть хід розв’язання задачі.
Додаткове завдання
З якими речовинами може взаємодіяти натрій гідроксид:
✓ калій оксид,
✓ ортофосфатна кислота,
✓ вода,
✓ ферум(ІІІ) сульфат,
✓ цинк оксид,
✓ сульфуp(IV) оксид?
Запишіть рівняння реакцій.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:19, Переглядів: 3869