§ 41. Загальні способи добування кислот, основ та солей
Пригадайте: класифікацію оксидів, солей, кислот та основ повторіть загальні способи добування оксидів, яку інформацію можна отримати з ряду активності металів та умови перебігу реакцій обміну.
Способи добування кислот
Ви вже ознайомилися з усіма основними класами неорганічних сполук та їхніми хімічними властивостями. У хімічних перетвореннях у більшості випадків з речовини, що належить до одного класу, утворюється інша речовина, що часто належить до іншого класу. Отже, хімічні властивості одних речовин є способом добування інших речовин.
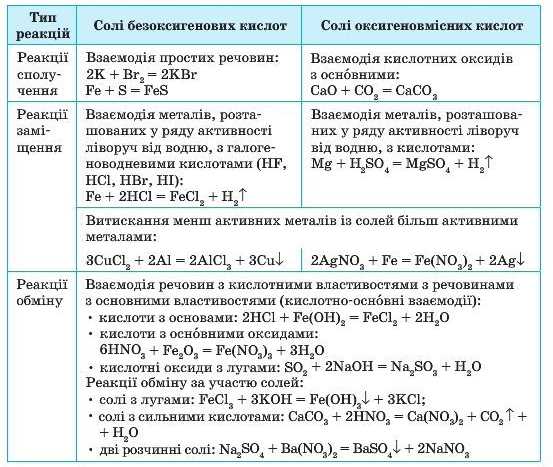
Способи добування оксигеновмісних та безоксигенових кислот дещо розрізняються (табл. 13):

Способи добування основ
Луги добувають різними способами:
• взаємодією лужних і лужноземельних металів (крім магнію) з водою:
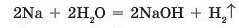
• взаємодією основних оксидів з водою:
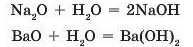
• реакціями обміну:
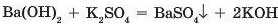
Нерозчинні гідроксиди добувають взаємодією розчинних солей з лугами:
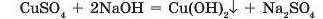
Луги також можна добути дією електричного струму на водні розчини солей —електролізом:
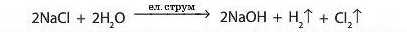
Способи добування солей
Солі утворюються в багатьох хімічних реакціях, тому існує багато способів добування солей.
Солі безоксигенових кислот можна добути взаємодією двох простих речовин: металу й неметалу. Активні метали, розташовані на початку ряду активності, з активними неметалами взаємодіють дуже бурхливо: з виділенням великої кількості теплоти і, часто, світла (мал. 41.1):
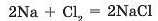
2
Менш активні метали також можуть взаємодіяти з активними неметалами, але за відповідних умов.
При внесенні заліза в колбу з хлором реакція за звичайних умов не відбувається. Але якщо залізні дроти попередньо розжарити в полум’ї пальника, то реакція відбувається дуже активно. Про протікання реакції свідчить виділення ферум(ІІІ) хлориду у вигляді бурого диму (мал. 41.2):
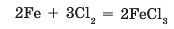
Солі оксигепоамісних кислот взаємодією двох простих речовин добути не можна.
Загальні способи добування солей вам вже відомі за попередніми параграфами, вони наведені в таблиці 14.

Висновки
1. Безоксигенові кислоти можна добувати взаємодією простих речовин з воднем з подальшим розчиненням продуктів реакції у воді. Слабкі кислоти можна добути витисканням із солі сильною кислотою.
2. Луги добувають взаємодією активних металів, що розташовані в ряду активності ліворуч від магнію, або оксидів активних металічних елементів з водою. Нерозчинні гідроксиди добувають взаємодією розчинних солей з лугами.
3. Солі добувають багатьма способами. Серед них можна виділити реакції сполучення: взаємодія металів з неметалами з утворенням солей безоксигенових кислот та кислотних оксидів з основними з утворенням солей оксигеновмісних кислот. Реакції заміщення: взаємодія металів з кислотами або солями. Реакції обміну можливі за участю сполук кислотного та основного характеру, а також за участю солей.
1. Які кислоти можна добути розчиненням газуватих речовин у воді?
2. Чи можна добути оксигеновмісні кислоти реакцією сполучення між простими речовинами? Відповідь поясніть.
3. Поясніть, чому луги можна добути взаємодією металів з водою, а нерозчинні гідроксиди — ні.
4. Якій умові має відповідати реакція обміну за участю розчинних солей, щоб у результаті можна було б добути сіль?
5. Яким умовам мають відповідати реагенти, щоб можна було здійснити реакцію заміщення з утворенням солі?
Завдання для засвоєння матеріалу
1. Наведіть по одному прикладу рівнянь реакцій, що відтворюють такі способи добування солей: а) сіль безоксигенової кислоти реакцією сполучення; б) сіль оксигеновмісної кислоти реакцією сполучення; в) реакція заміщення за участю кислоти; г) реакція заміщення за участю солі; д) реакція обміну за участю кислотного оксиду; е) реакція обміну за участю основного оксиду; є) реакція обміну за участю нерозчинної солі; ж) реакція обміну за участю нерозчинного гідроксиду; з) реакція обміну за участю розчинної солі; и) реакція обміну за участю нерозчинної кислоти.
2. Складіть рівняння реакцій добування кислот: а) взаємодією двох оксидів; б) взаємодією кислоти і солі; в) взаємодією двох простих речовин (з наступним розчиненням продукту реакції у воді).
3. Складіть рівняння реакції добування плюмбум(ІІ) сульфіду: а) реакцією сполучення; 6) реакцією заміщення; в) реакцією обміну.
4. Складіть рівняння реакції добування купрум(ІІ) сульфату: а) реакцією сполучення; 6) реакцією заміщення; в) реакцією обміну.
5. Білий осад розчиняється при взаємодії з нітратною кислотою І натрій гідроксидом. Яка речовина могла бути в осаді? Відповідь підтвердьте рівняннями реакцій.
6. Складіть рівняння можливих реакцій:
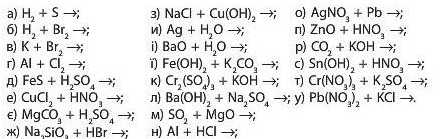
7. Складіть рівняння реакцій, що відповідають таким перетворенням:
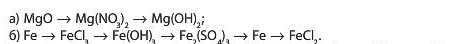
8. Дано солі: аргентум(І) нітрат, магній карбонат, ферум(ІІ) сульфід, калій сульфіт, плюмбум(ІІ) нітрат. Які з них взаємодіятимуть з хло-ридною кислотою з утворенням: а) осаду; б) газу? Складіть рівняння реакцій.
9. Як із натрій хлориду добути натрій сульфат? Складіть рівняння реакцій.
10. Як із ферум(ІІІ) сульфату добути ферум(ІІІ) оксид? Складіть рівняння реакцій.
11. Як з ферум(ІІІ) оксиду у дві стадії одержати ферум(ІІІ) гідроксид? Складіть рівняння реакцій.
12. Складіть рівняння реакції добування не менше ніж семи солей, використовуючи такі реактиви: ртуть, цинк, хлоридна кислота, фосфор{\/) оксид, магній оксид, аргентум нітрат, барій карбонат, ферум(ІІІ) гідроксид.
13. Хлор об'ємом 5,6 л (н. у.) змішали з достатньою кількістю водню й підірвали. Продукт реакції розчинили у воді масою 200 г. Обчисліть масову частку хлоридної кислоти в отриманому розчині.
14. До розчину натрій карбонату масою 200 г із масовою часткою солі 5,3 % додали надлишок хлоридної кислоти. Обчисліть об'єм газу, що виділився (н. у.).
15. Кальцій карбонат масою 0,5 кг обробили розчином нітратної кислоти. Обчисліть масу солі, що можна добути в такий спосіб.
16. Розчин масою 50 г з масовою часткою сульфатної кислоти 7,35 % змішали з розчином натрій гідроксиду. Отриманий розчин не змінює забарвлення лакмусу. Обчисліть масу солі в розчині.
Дослідження властивостей основних класів неорганічних сполук
Обладнання: штатив із пробірками, корок з газовідвідною трубкою. Реактиви: кальцій карбонат, порошок заліза, 5%-й розчин хлоридної кислоти, розчини сульфатної кислоти, натрій або калій гідроксиду, кальцій гідроксиду, натрій хлориду, натрій ортофосфату, аргентум(І) нітрату, кальцій хлориду, натрій карбонату, натрій сульфіту.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння лугу або кислоти їх слід негайно змити великою кількістю води та протерти місце розбавленим розчином боратної кислоти (у випадку потрапляння лугу) або розчином соди (у випадку кислоти).
1. Добування й хімічні властивості оксидів
1. У пробірку помістіть невеликий шматок кальцій карбонату (крейди, вапняку або мармуру) і долийте 5%-й розчин хлоридної кислоти.
2. Пробірку закрийте корком з газовідвідною трубкою. Вільний кінець трубки занурте в іншу пробірку з вапняною водою.
3. Запишіть свої спостереження в зошит, укажіть колір осаду, що утворюється в другій пробірці.
4. Запишіть рівняння реакцій.
2. Добування і хімічні властивості нерозчинних гідроксидів
1. У пробірку помістіть невелику кількість порошку заліза (на кінчику шпателя) і долийте до нього 1-2 мл розчину хлоридної кислоти.
2. Після закінчення реакції до добутого розчину прилийте 0,5—1 мл розчину лугу (натрій або калій гідроксиду) до утворення осаду.
3. До отриманого осаду приливайте невеликими порціями розчин сульфатної кислоти, поки осад не зникне.
4. Запишіть свої спостереження в зошит, укажіть колір осаду.
5. Запишіть рівняння реакцій.
3. Добування і хімічні властивості солей
1. У дві пробірки налийте по 1—2 мл розчинів натрій хлориду та натрій ортофосфату.
2. До кожної пробірки долийте по 1 мл розчину аргентум(І) нітрату. Укажіть колір осадів, що утворилися, і запишіть рівняння реакцій.
3. У дві пробірки налийте по 1—2 мл розчину кальцій хлориду.
4. У першу пробірку долийте 1 мл розчину натрій карбонату, а в другу — 1 мл розчину натрій сульфіту до утворення осадів.
5. До кожної пробірки додавайте розчин хлоридної кислоти, поки осади не зникнуть.
6. Запишіть свої спостереження в зошиті та складіть рівняння реакцій.
4. Формулювання висновків
При формулюванні висновків дайте відповіді на такі запитання:
1. Які способи добування оксидів, основ та солей ви використали в практичній роботі?
2. Для реакцій обміну поясніть, яким умовам відповідають ці реакції та завдяки чому можливо протікання реакцій.
3. Для реакцій заміщення поясніть можливість протікання цих реакцій.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:09, Переглядів: 9943