§ 38. Хімічні властивості солей
Пригадайте, як визначити, чи розчиняється неорганічна речовина (сіль, кислота або основа) у воді та умови перебігу реакцій обміну (за § 33).
Взаємодія солей з основами
Із § 33 ви вже дізналися про взаємодію лугів із кислотами. Реакція між солями та основами є реакцією обміну.
Зверніть увагу:
• щоб взаємодія між сіллю та основою відповідала умовам перебігу реакцій обміну, один з продуктів має випадати в осад;
• оскільки нерозчинні речовини не можуть бути одночасно серед реагентів і продуктів, то в такі реакції можуть вступати тільки розчинні солі з лугами.
Отже:
сіль розчинна(І) + луг —» нерозчинний гідроксид 4- сіль(2)

Такі реакції часто використовують для добування нерозчинних у воді основ.
Наприклад, при взаємодії розчинів купрум(ІІ) хлориду та натрій гідроксиду випадає осад купрум(ІІ) гідроксиду з характерним забарвленням (мал. 38.1):
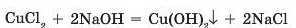
Якщо прилити розчин солі до нерозчинної основи, наприклад ферум(ІІ) гідроксиду, то така реакція не відбуватиметься:
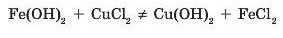
Луги є сильними основами, а нерозчинні гідроксиди — слабкими. Отже, реакція між сіллю й основою відбувається тільки в тому випадку, якщо сильніша основа (луг) витискує слабкішу (нерозчинну) із солі. Отже, сіль з лугом взаємодіяти може, а сіль з нерозчинною основою — ні.
Взаємодія солей з кислотами

Із § 35 ви вже дізналися про взаємодію солей з кислотами. Такі реакції є реакціями обміну, отже в результаті мають утворитися нові сіль та кислота:
сіль (1) + кислота (1) —» —» сіль (2) + кислота (2)
Як ви пам’ятаєте, реакції між сіллю та кислотою можливі за умови, що
• випадає осад;
• виділяється нестійка чи летка кислота.
Наприклад, при взаємодії аргентум(І) нітрату з хлоридною кислотою реакція відбувається із утворенням білого сирнистого осаду (мал. 38.2):
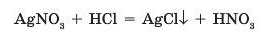
Нестійкі кислоти утворюються в реакціях кислот з карбонатами або сульфітами. Наприклад, при додаванні до барій сульфіту хлорид-ної кислоти спостерігаємо зникнення нерозчинного барій сульфіту, оскільки нова сіль розчинна у воді. Але утворена сульфітна кислота є нестійкою, вона повільно розкладається, про що свідчить поява запаху сульфур(ІУ) оксиду (сірчистого газу):
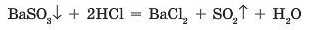
Реакції між двома солями
Дві солі також можуть вступати в реакцію одна з одною. Між ними може відбуватися реакція обміну. Звичайно, якщо в реакцію вступають дві солі, то і продуктами реакції мають бути дві солі.
Зверніть вагу: взаємодія двох солей можлива лише в тому випадку, якщо обидві початкові солі розчинні у воді і хоча б один з продуктів реакції випадає в осад, тобто серед продуктів одна сіль має бути нерозчинною або малорозчинною у воді:
сіль розчинна (1) + сіль розчинна (2) -»
—> сіль нерозчішна (3)1 + сіль (4)

Наприклад, добути малорозчинний кальцій флуорид або нерозчинний плюмбум(ІІ) йодид можна за такими рівняннями реакцій (мал. 38.3 та 38.4):
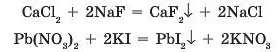
Якщо при змішуванні двох розчинних солей серед продуктів реакції немає нерозчинної солі, то такі реакції не відбуваються:
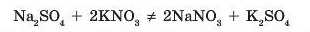
Іноді в реакцію можуть вступати розчинна сіль з нерозчинною. Але це можливо, якщо утворюється така сіль, розчинність якої ще менша. Тобто потрібно знати чисельні показники розчинності реагентів та продуктів реакції. Наприклад, кальцій сульфат — малорозчинна сіль, а барій сульфат — нерозчинна, отже можлива реакція:
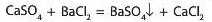
Аргентум хлорид і аргентум йодид — нерозчинні солі, але аргентум хлориду в 1 л води розчиняється 1,9 мг, а аргентум йодиду — лише 0,0024 мг. Отже, аргентум йодид менш розчинний, ніж аргентум хлорид, тому можлива реакція:
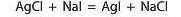
Аргентум хлорид має біле забарвлення, а аргентум йодид — жовтувате. Про перебіг реакції можна дізнатися за зміною кольору осаду, але через те, що реагують нерозчинні речовини, такі реакції відбуваються надто повільно і змін, які відбуваються, майже не видно.
• Наприкінці XIX ст. в Петербурзькій академії наук розглядали пропозицію щодо назв речовин на кшталт російських прізвищ. Так гідроген хлорид (хлороводень) HCI пропонували називати «водень хлоровим», а натрій сульфат NajSOj — «натрій сірковим чотирикислов».
• Для золочення куполів, деревини, гіпсових і мозаїчних виробів іноді використовували так зване мусивне золото. Але воно не містить ані грама золота, це — CraHyM(IV) сульфід, з якого виготовляють фарбу, що імітує позолоту.
• Крім звичайного цукру, хімікам відомий ще свинцевий цукор, що є плюмбум(ІІ) ацетатом Pb(CH3COO)j. На вигляд він дуже схожий на звичайний цукор, також солодкий і добре розчиняється у воді, але надзвичайно отруйний.
Взаємодія солей з лугами у водному розчині
Обладнання: штатив із пробірками, піпетки.
Реактиви: розчини купрум(ІІ) сульфату, ферум(Н) сульфату, ферум(ІН) хлориду, манган(П) сульфату, хром(ІІІ) хлориду, натрій гідроксиду'.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння лугу його слід негайно змити великою кількістю води та протерти місце розбавленим розчином боратної кислоти.
1. У п’ять пробірок налийте по 1—2 мл розчинів купрум(ІІ) сульфату, ферум(П) сульфату, ферум(Ш) хлориду, манган(ІІ) сульфату та хром(ІІІ) хлориду.
2. До кожної пробірки по краплях приливайте розчин лугу. Які зміни ви спостерігаєте?
3. Запишіть рівняння реакцій та укажіть колір утворених осадів.
4. У висновоку сформулюйте умови взаємодії солей з лугами у водному розчині.
Реакція обміну між солями в розчині
Обладнання: штатив із пробірками.
Реактиви: розчини натрій карбонату, кальцій хлориду, натрій сульфату, калій нітрату.
Правила безпеки:
• при виконанні дослідів використовуйте невеликі кількості реактивів;
• остерігайтеся потрапляння реактивів на одяг, шкіру, в очі; у разі потрапляння реактивів їх слід негайно змити великою кількістю води.
1. У три пробірки налийте по 1—2 мл розчину кальцій хлориду.
2. У першу пробірку додайте стільки ж розчину натрій карбонату, у другу — натрій сульфату, у третю — калій нітрату.
3. Запишіть спостереження в зошит.
4. Складіть рівняння тих реакцій, що відбуваються.
5. У висновку сформулюйте умови, за яких відбуваються реакції обміну у водних розчинах.
Висновки
1. Реакції обміну між солями та основами можливі за умови, що взаємодіють розчинна сіль з лугом (розчинною основою), а продуктами реакції є нерозчинний гідроксид та інша сіль.
2. У реакцію з кислотами можуть вступати як розчинні, так і нерозчинні солі. У результаті мають утворитися летка чи нестійка кислота або нерозчинна сіль.
3. У реакціях обміну між двома солями мають утворитися дві нові солі. Реакція відбувається, якщо обидва реагенти розчинні, а серед продуктів реакції одна із солей нерозчинна у воді.
Контрольні запитання
1. Речовини яких класів сполук утворюються при взаємодії: а) солі з кислотою; 6) солі з основою; в) двох солей?
2. Сформулюйте умови, за яких можливі реакції обміну у водних розчинах: а) між сіллю та кислотою; 6) між сіллю та основою; в) між двома солями. Наведіть приклади реакцій.
3. Які кислоти є нестійкими? Наведіть рівняння реакції їх розкладу.
Завдання для засвоєння матеріалу
1. Яка речовина випаде в осад, якщо змішати розчини кальцій нітрату і сульфатної кислоти? Складіть рівняння реакції. Чи можна очікувати випадання осаду, якщо замість сульфатної кислоти взяти хлоридну? Сульфітну?
2. Складіть рівняння реакції добування вуглекислого газу з мармуру (кальцій карбонату) взаємодією з бромідною кислотою.
3. Як добути з барій хлориду: а) барій карбонат; б) аргентум хлорид? Складіть рівняння реакцій.
4. При зливанні яких розчинів утворяться осади: а) купрум(ІІ) гідроксиду;
6) плюмбум(ІІ) сульфату; в) кальцій карбонату? Складіть рівняння реакцій.
5. У пробірках містяться речовини: магній оксид, калій хлорид, залізо, плюмбум(ІІ) нітрат, купрум(ІІ) сульфат, сульфатна кислота, ферум(ІІ) гідроксид, сульфур(УІ) оксид. З якими з речовин взаємодіятимуть: а) хло-ридна кислота; б) калій гідроксид; в) аргентум нітрат; г) барій нітрат? Складіть рівняння реакцій.
6. Визначте, які з речовин взаємодіятимуть між собою: кальцій гідроксид, хлоридна кислота, сульфур(ІУ) оксид, вода, купрум(ІІ) оксид. Складіть рівняння реакцій.
7. Запишіть рівняння реакцій, які можуть відбуватися. Поясніть, чому деякі DeaKuii не відбуваються:
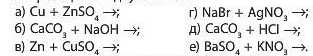
8, Допишіть рівняння реакцій обміну і вкажіть, з якої причини відбувається кожна з них:
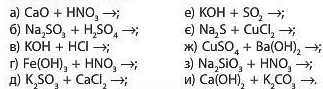
9. З якими з наведених речовин взаємодіє купрум(ІІ) хлорид: NaOH, HjSO4, AgNOj, FejOj, COj, Zn, NaCI, Cu? Складіть рівняння реакцій.
10. Складіть рівняння реакцій, що відповідають таким перетворенням:
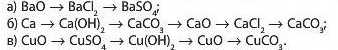
11. Безводну нітратну кислоту в лабораторії добувають дією на калійну селітру (калій нітрат) концентрованої сульфатної кислоти. Складіть рівняння реакції. Як ви вважаєте, чому ця реакція можлива?
12. Обчисліть масу осаду, що утворюється при взаємодії натрій сульфату з барій хлоридом масою 41,6 г.
13. Обчисліть об'єм вуглекислого газу (н. у.), що виділяється при взаємодії магній карбонату масою 126 г із хлоридною кислотою.
Автор: admin от 13-09-2016, 18:07, Переглядів: 7395