§ 29. Солі. Їхні фізичні й хімічні властивості
— А ти знаєш, звідки походить слово «сіль»?
— Ні. Я знаю, що сіль у нас стоїть завжди на столі.
— Саме ця звичайна кухонна сіль NaCl і дала назву всім солям. Вважають, що слово «сіль* походить від слова «сонце», під яким випарювали морську сіль для одержання дорогоцінного NaCl.
— Так яка ж вона дорогоцінна! У будь-якому магазині купити можна, і коштує недорого.
— Це зараз. В історії людства були й «соляні» бунти, і «соляні» війни — все тому, що жити без солі ми, люди, не можемо. Вона нам необхідна.
Тому ще у ХУІП столітті вважали багатою людиною того, у кого була сіль.
— Та?:... Тепер зрозуміло, чому чумаки сіль возили.
СКЛАД І НАЗВИ СОЛЕЙ
Як ми вже знаємо, солями називають складні речовини, в яких йони металу пов’язані з кислотними залишками. Такі солі називають середніми.
Якщо ви забули, як складати формули солей і називати їх, поверніться до §20.
Будь-яку сіль можна представити як продукт заміщення йонів Гідрогену в кислоті на йони металу.
Винятком є солі амонію, в яких із кислотними залишками пов’язані не йони металу, а йони амонію NH4. Ці солі ми будемо вивчати в 10 класі.
Крім хімічних назв у солей збереглися й традиційні, історично сформовані назви. їх іще називають тривіальними. У таблиці 15 наведено назви деяких солей згідно з прийнятою сучасною номенклатурою та традиційні (тривіальні) назви солей.
Таблиця 15
Сучасні н традиційні назви деяких солей
|
Сіль |
Сучасна назва |
Традиційна назва |
|
Na2CO3 |
Натрій карбонат |
Кальцинована сода |
|
NaHCO3 |
Натрій гідрогенкарбонат |
Питна сода |
|
K2CO3 |
Калій карбонат |
Поташ |
|
Na2SO1 |
Натрій сульфат |
Глауберова сіль |
|
MgSO4 |
Магній сульфат |
Англійська сіль, гірка сіль |
|
KClO3 |
Калій хлорат |
Бертолетова сіль |
|
KNO3 |
Калій нітрат |
Калійна селітра |
|
NaNO3 |
Натрій нітрат |
Натрієва селітра |
|
CaCO3 |
Кальцій карбонат |
Крейда, мармур, вапняк |
|
CaSO4 |
Кальцій сульфат |
Гіпс, алебастр |
Є кілька речовин, до назви яких входить слово «сода». У жодному разі не можна плутати кальциновану' соду Na2CO3 і питну соду NaHCO3. Якщо ненавмисно використати в їжу
кальциновану соду замість питної соди, можна одержати важкий хімічний опік. А каустична сода — зовсім не сіль, це технічна назва натрій гідроксиду NaOH. Якщо звичайною содою можна почистити раковину або посуд, то каустичну соду ні за яких умов брати в руки або використовувати в побуті не можна! Ці прості знання можуть знадобитися у житті — ніколи не знаєш, які речовини нам трапляться.
ПРАВИЛА РОБОТИ ІЗ СОЛЯМИ
Сухі солі для дослідів треба брати в невеликих кількостях, насипати спеціальною ложкою або шпателем. У жодному разі не пробувати солі на смак! Серед них багато отруйних. Є й вибухонебезпечні солі. Тому працювати з ними потрібно обережно.
 |
CuSO4— токсична, фізіологічно небезпечна речовина |
 |
BaCl2 токсична, фізіологічно небезпечна речовина |
 |
KMnO1 токсична, фізіологічно небезпечна речовина |
 |
Вогненебезпечно! |
 |
Вибухонебезпечно! |
 |
Обережно, отруйна речовина! |
ФІЗИЧНІ ВЛАСТИВОСТІ СОЛЕЙ
Всі солі — тверді речовини, в основному йонної будови, але фізичні властивості (температури кипіння, плавлення, густини, твердість) у них різні. Як правило, це нелеткі речовини без запаху, крихкі, частіше білого кольору, але серед них трапляються й забарвлені. Так, водні розчини солей Купруму — блакитного ко-льору, Fe' — жовто-коричневого, Школу — зеленого. Кобальту — рожевого та ін. Часто солі утворюють гарні кристали.

Розчинність у воді різна, тому для її визначення слід зазирнути в «Таблицю розчинності».
ХІМІЧНІ ВЛАСТИВОСТІ СОЛЕЙ
Частину хімічних властивостей ми вже знаємо. Вони траплялися нам під час вивчення хімічних властивостей інших класів.
Напишіть найбільш відомі вам властивості солей, а потім звірте свою відповідь із підручником.
Якщо ви написали, що солі реагують із лугами, ви праві. Ми це вже знаємо.
1. Взаємодія солей із лугами
Обидва реагенти в цьому випадку обов’язково розчинні, а в результаті реакції має утворитися осад.
Це реакція обміну.
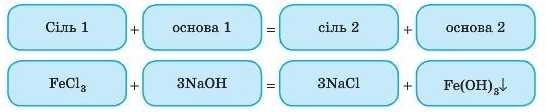
Дослід
Якщо до розчину ферум(ІІІ) хлориду додати розчин лугу, випадає осад бурого кольору.
FeCl3 NaOH FeiOH^i + NaCl
Якщо ви написали, що солі реагують із кислотами, ви знову праві. Повторимо цю властивість.
2. Взаємодія солей із кислотами
Як ви пам’ятаєте, у цьому випадку більш сильна кислота витісняє більш слабку або летку (див. § 27). Це реакція обміну.
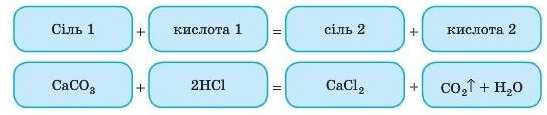
Дослід
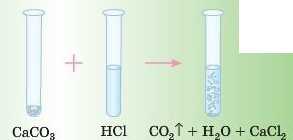
Якщо до шматочків крейди (а вона складаєть ся в основному з CaCO3) додати НС1, побачимо, як активно утворюються бульбашки газу CO2^.
Ми знаємо, що кислота, яка утворюється в результаті цієї реакції H2CO8, легко розкладається на оксид і воду.
Ця реакція можлива й тоді, коли утворюється сіль, нерозчинна в кислотах:
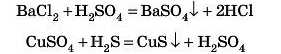
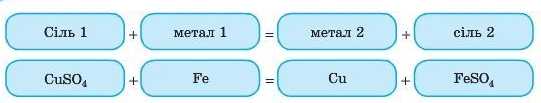
А тепер розглянемо нові хімічні властивості солей. 3. Взаємодія солей із металами
Більш активні метали здатні витісняти менш активні метали з розчинів їх солей.
Як дізнатися, який метал більш активний? Звичайно, скористаємося вже знайомим рядом активності металів.
Метали, що розташовані в ряді активності металів лівіше, є більш активними.
При цьому неважливо, до або після водню в ряді активності стоїть метал. Це реакція заміщення.

Дослід
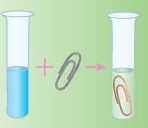
Проведіть найпростіший дослід, з основою якого є взаємодія металів із солями: киньте скріпку або цвях (без іржі) у розчин купрум(П) сульфату (мідного купоросу). Буквально через кілька хвилин на поверхні скріпки або цвяха з’явиться начіт міді. Не поспішайте закінчувати дослід і подивіться, що буде через день. Спробуйте разом з учителем розібратися в усіх хімічних реакціях, які відбуватимуться. Дослід потрібно виконувати в шкільній лабораторії, тому що солі Купруму отруйні!
Приклад. Подумайте, яка з цих реакцій можлива:
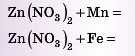
Звичайно, перша. У ряді активності Mn стоїть до Zn, отже, він більш активний і витіснить Zn із його солі.
Завдання. Спробуйте самі закінчити рівняння можливих реакцій.
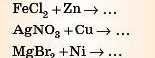
Відповідь 1 дивіться наприкінці параграфа.
Важливо! У таких реакціях заміщення як більш активний метал не можна брати лужні й лужноземельні метали, томі' що вони будуть реагувати з водою (це ж водний розчин солі!) і ми не одержимо очікувану реакцію заміщення.
Розберемо, що відбудеться, якщо в розчин купрум сульфату KHHijTH шматочок натрію.
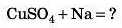
Не треба очікувати, що Натрій витисне Купрум із солі й утворяться металева мідь і натрій сульфат.
Насправді тут відбуватиметься кілька реакцій:
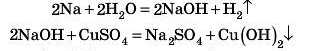
Оскільки реакція відбувається з виділенням великої кількості тепла, то нерозчинний гідроксид розкладається:
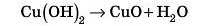
Таким чином, ми одержимо осад купрум гідроксиду, купрум оксиду й натрій сульфат у розчині.
Треба визнати, що в цьому випадку можливе відновлення воднем міді з оксиду Купруму, тож невелику кількість міді ми можемо одержати, але процес одержання зовсім інший.
4. Взаємодія солей із солями
Важливо! Якщо реакцію проводити в розчині, то обидві реагуючі солі повинні бути розчинними, а в результаті реакції має утворитися нерозчинна сіль.
Це реакція обміну.
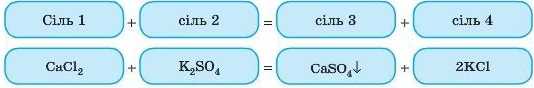
Дослід
Проведемо дослід: до розчину кальцій хлориду додамо розчин розчинного сульфату, наприклад калій сульфату. Через невеликий час утвориться білий осад.
Завдання. Спробуйте виконати самостійно таке завдання:
Яка із цих реакцій можлива?
1) CaCO3+NaCl =
2) KNO3+ FeCl3 =
3) AgNO3+CaCl2 =
Відповідь 2 дивіться наприкінці параграфа.
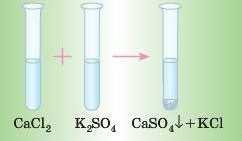
5. Розклад солей при нагріванні
Деякі солі під час нагрівання розкладаються. При цьому можуть утворитися як оксиди, так і інші солі:
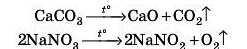
Це реакції розкладу.
Зверніть увагу на останню реакцію. У продуктах реакції — кисень. Він підтримує горіння. Тому над розплавом цієї солі можуть горіти папір, вугілля, сірка тощо.
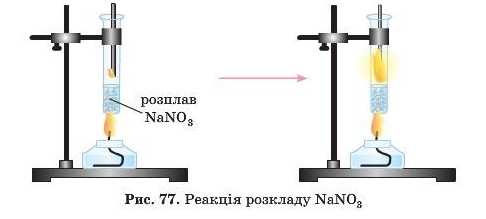
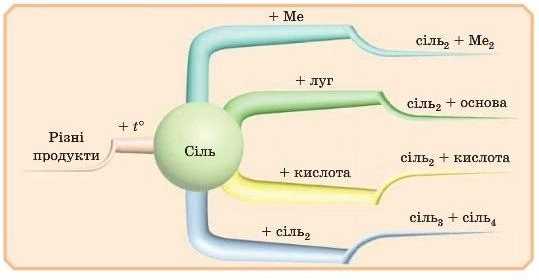
Отже ми розглянули п’ять хімічних властивостей солей. Дві з них ми вже вивчили раніше.
Залишилося запам’ятати: сіль -H сіль, сіль -H метал і розклад під час нагрівання (не для всіх солей). Спробуйте вдома скласти схему хімічних властивостей солей, яка допоможе вам їх запам’ятати. А ми намалюємо свою:
ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1
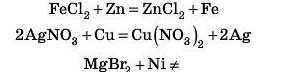
Відповідь 2
Для правильної відповіді необхідна таблиця розчинності. Реакція 1 неможлива, тому що реагуюча сіль CaCO3 нерозчинна. Реакція 2 3KN03 +FeCl3 Ф ЗКС1 + Fe(NO3)3 неможлива, тому що не утворюється осад — обидві отримані солі розчинні. А от реакція З відбуватиметься:
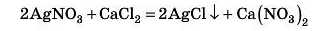
Обидві реагуючі солі розчинні, а в результаті реакції утворюється нерозчинна сіль AgCl.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Солі — це речовини, в яких:
а) атоми Гідрогену пов’язані з кислотними залишками;
б) атоми Сульфуру пов’язані з кислотними залишками;
в) йони металу пов’язані з кислотними залишками;
г) атоми Оксигеиу пов’язані з кислотними залишками.
2. Розкажіть, як правильно складати формули солей.
3. Назвіть тини всіх хімічних реакцій, згаданих у описі хімічних властивостей солей.
ВИКОНАЙТЕ ЗАВДАННЯ
1. Дано схеми реакцій:
а) кислота + сіль -+ в) луг + сіль -+
б) основний оксид + кислотний оксид —» г) метал + сіль Підберіть самостійно речовини й закінчіть рівняння.
2. Закінчіть рівняння реакцій і порівняйте їх, урахуйте, що утворюються середні солі. Назвіть отримані солі.
а) Al(OH)8+H2SO4 =
б) KOH+ H2SO4 =
в) Ca(OH)2+H3PO4 =
Обчисліть, скільки солі утвориться в кожному випадку, якщо взято по 100 г вихідних основ.
3. Напишіть не менше трьох рівнянь одержання натрій сульфіде
4. Заповніть пропуски в рівняннях реакцій, не забудьте зрівняти
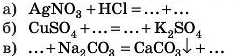
5. Ферум(ІІ) хлорид реагує з кожною з двох речовин:
а) MgO, НС1; в) HNO8, CO2;
б) Zn, AgNO8; г) CaO, CO2.
відповідь підтвердьте рівняннями реакцій.
6. Виберіть варіант, у якому розчин купрум(ІІ) сульфату реагує з обома речовинами:

Напишіть рівняння реакцій. Обчисліть, скільки молів кожної з цих речовин прореагує з 240 г купрум(ІІ) сульфату.
ДЛЯ допитливих
1. У двох пробірках містяться прозорі безбарвні розчини натрій карбонату й натрій сульфату. Як визначити, в якій пробірці міститься кожна сіль? Відповідь підтвердьте рівняннями реакцій.
2. Один учень вирішив розчинити шматочок крейди в сульфатній кислоті, інший — у хлоридній. Як ви вважаєте, реакції в них відбуватимуться однаково? Відповідь підтвердьте рівняннями реакцій.
Підказка: подивіться розчинність отриманих солей у таблиці розчинності.
3. Дано три пробірки з прозорими безбарвними розчинами. Відомо, що в одній пробірці — розчин лугу, в іншій — розчин кухонної солі, у третій — вода. Як визначити, яка речовина міститься в якій пробірці?
4. Куирум(ІІ) оксид розчинили в сульфатній кислоті. Отриманий розчин упарили — випали кристали солі. Складіть рівняння реакції та вкажіть назву отриманої солі.
Підказка: упарили — довго гріли, поки не випарилася значна частина води.
5. Як визначити, чи міститься домішка барій карбонату в барій сульфаті? Обидві солі — білі кристалічні речовини. Як можна видалити цю домішку? Відповідь підтвердьте рівняннями реакцій.
6. Говорять, королі розчиняли перли у вині. Чи розчиняться там перли? Чому?
7. Як очистити яйце, не розбиваючи його?
8. Ipa й Таня вирішили зробити мамі сюрприз і спекти млинчики. Але ненавмисно насипали занадто багато соди. Чим її можна нейтралізувати? Урахуйте, що млинчики потім можна було їсти. Відповідь мотивуйте. Напишіть рівняння реакцій.
9. Алхіміки вважали одним із доказів можливості перетворення одного металу на інший наступне спостереження рудокопів, які добувають мідні руди: їхні залізні кирки покривалися міддю з поверхні під час зіткнення з рудничними водами. Яким є правильне пояснення цього явища?
10. Аристотель вважав золото найблагороднішим із металів, а інші відомі в його час метали розташовував за ступенем зменшення «благородства» в такий ряд: срібло, мідь, олово, залізо. Що являє собою аристотелівський ряд металів із сучасної точки зору?
ДОМАШНІ ЕКСПЕРИМЕНТИ
1. Пірнаюче яйце
(Просимо допомоги батьків!)
Перед виконанням експерименту треба підготувати собі на кухні робоче місце, надіти спеціальний одяг, заслати стіл клейонкою. Під час досліду слід користуватися спеціальним посудом і обладнанням. Після закінчення роботи все прибрати та помити руки.
Працювати з полум’ям газового пальника й сухого пального треба обережно.
У півлітрову банку, ущерть наповнену розчином оцтової кислоти (9% оцет розведіть водою у співвідношенні 1:1), опустіть невелике яйце — воно потоне. Але через деякий час воно спливе на поверхню. Якщо яйце важке й не спливає, додайте невелику кількість насиченого розчину кухонної солі. Якщо яйце не виймати з оцту, шкаралупа може повністю розчинитися й уміст яйця виявиться у м’якій підшкаралу повій оболонці. Поясніть, бульбашки якого газу виносять яйце на поверхню? Чому яйце знову тоне, коли бульбашки газу відриваються від поверхні яйця?
2. Живе яйце, або хімічна вертушка
Проколіть яйце товстою голкою з двох боків та акуратно видуйте вміст у домашній посуд (можна вживати в їжу). Висушіть шкаралупу й через отвір заповніть наполовину сумішшю лимонної кислоти (візьміть на кухні) та питної соди. Соду й кислоту
візьміть у пропорції 1:1. Закрийте проколини гарячим парафіном (використайте свічку). Опустіть яйце у воду й позначте дві симетричні крапки нижче за поверхню води (на двох протилежних боках яйця). Зробіть голкою отвори. Знову покладіть яйце у воду — воно починає крутитися. Поясніть, чому яйце починає крутитися.
3. Незвичайне розкладання солі, або фараонові змії
На таблетку сухого пального або на конфорку газового пальника кладемо таблетки кальцій глюконату (сіль органічної кислоти, яку використовують у медицині для боротьби з алергією), підпалюємо. Спостерігаємо появу «змій» темно-сірого кольору, які начебто прокидаються й починають виповзати з таблетки. Чим довше буде нагріватися таблетка, тим довшою буде змія. Поясніть, чому рухаються змії.
4. Солі металів забарвлюють полум'я
Увімкніть газовий пальник на кухні. Посоліть полум’я кухонною сіллю (NaCl), питною содою (NaHCO3), розтовченою крейдою (CaCO3). Зробіть висновок, у який колір забарвлюють полум’я солі, що містять йони Натрію та йони Кальцію. Вимкніть газовий пальник і приберіть розсипані кристали солі.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:17, Переглядів: 9342