Загальні способа добування оксидів, кислот, основ, солей
Після опрацювання параграфа ви зможете:
• назватизагальні способи добування оксидів, кислот, основ, солей, схарактеризувати їхта складативідповідні рівняння реакцій;
• встановлюватигенетичний зв'язок між простими і складними речовинами, класами неорганічних сполук.
Під час вивчення теми «Основні класи неорганічних сполук» ви накопичили чималий обсяг знань про їхні хімічні властивості та генетичні зв’язки між ними. Тож час систематизувати здобуті відомості й узагальнити їх.
Добування оксидів здійснюють у різні способи. Ви вже знаєте з курсу хімії 7 класу, що оксиди є продуктами взаємодії простих і складних речовин з киснем (рис. 33.1). Винятки - золото, платина, інертні гази тощо. Ці речовини з киснем не реагують.

Завдання. Перетворіть ці і наведені далі схеми реакцій на хімічні рівняння
Оксиди утворюються й унаслідок розкладання деяких оксигеновміс-них речовин за нагрівання. Наприклад, випалюванням вапняку (кальцій карбонату) добувають негашене вапно (кальцій оксид) і вуглекислий газ (карбон(ІУ) оксид):
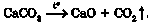
Поміж продуктів реакцій розкладу нерозчинних основ, деяких солей та оксигеновмісних кислот є оксиди:
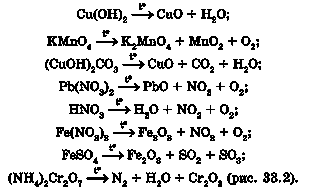
Унаслідок нагрівання солей з кислотними та амфотерними оксидами також можуть утворюватися оксиди. Можливість перебігу реакції в цьому випадку залежить від відносної леткості оксидів - менш леткий оксид витісняє більш леткий оксид із солі:
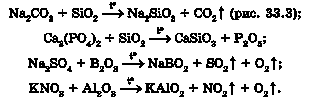
Добування кислот. Вам уже відомо, що взаємодією кислотних оксидів з водою добувають оксигеновмісні кислоти:
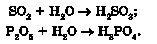
Безоксигенові кислоти утворюються під час розчинення у воді продуктів реакції водню з деякими неметалами. Саме так у промисловості виробляють хлоридну кислоту:
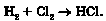

Поміж продуктів взаємодії солей слабких нестійких кислот із сильними кислотами є оксиди:
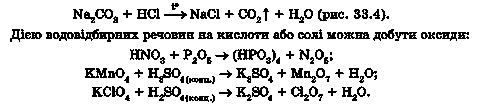

Продукт реакції водню із сіркою - гідроген сульфід (сірководень) - складник не лише лікувальних мінеральних, а й стічних вод. Однак у довкіллі він утворюється в інший спосіб, ніж той, що описує рівняння реакції:
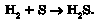
Ви вже знаєте, за яких умов (назвіть їх) можливі реакції обміну між сіллю й кислотою. Тому в лабораторії сірководень добувають дією розбавлених сильних кислот на сульфіди - солі слабкої сульфідної кислоти:
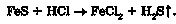
Уперше сірководень описав Карл Вільгельм Шеєле під назвою задушливого сірчаного газу. Шеєле отримав сірководень прямим синтезом і дією кислот на сульфіди Феруму(И) і Мангану(И).
Інші приклади добування кислот реакцією обміну описують схеми реакцій:
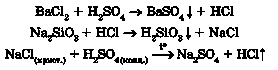
Добування основ. Луги добувають взаємодією оксидів активних металічних елементів з водою:
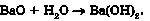
Продуктами взаємодії відповідних металів (пригадайте, де вони розміщені в періодичній системі та ряді активності) з водою (рис. 33.5) також є луги:
Спосіб добування нерозчинних основ реакціями обміну між лугом і сіллю в розчині вам також відомий:
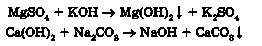
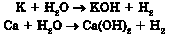
Добування середніх солей ґрунтується переважно на взаємодії речовин із протилежними властивостями:
1) металу з неметалом:
2) металу з кислотою в розчині (пригадайте, як за положенням металу в ряді активності спрогнозувати можливість перебігу цих реакцій):
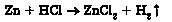
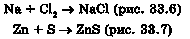
3) металу з розчином солі менш активного металу (пригадайте, як за положенням металу в ряді активності спрогнозувати можливість перебігу цих реакцій):

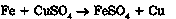
4) основного оксиду з кислотним оксидом:
5) основного або амфотерного оксиду з кислотою:
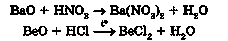
6) лугу з кислотним або амфотерним оксидом:
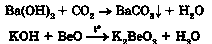
7) основи з кислотою:
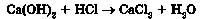
8) солі з кислотою:
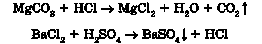
9) лугу із сіллю в розчині:
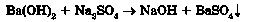
10) двох солей у розчині:
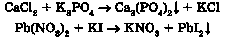
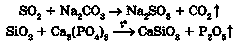
ПРО ГОЛОВНЕ
• Загальні способи добування оксидів, кислот, основ, солей ґрунтуються на генетичних зв’язках між представниками різних класів неорганічних сполук. Окрім загальних існують і специфічні способи добування окремих представників класів неорганічних сполук.
Перевірте себе
Відтворіть за наведеними фрагментами схем реакцій хімічні рівняння:
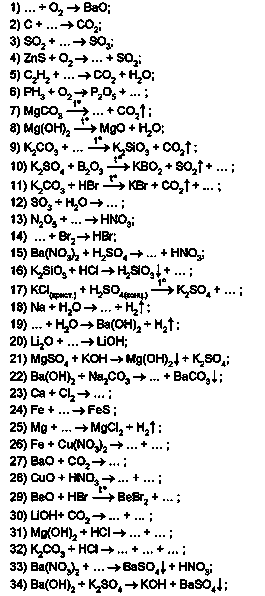
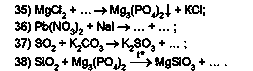
Назвіть реагенти та продукти хімічних реакцій. Класифікуйте хімічні реакції.
Застосуйте свої знання й уміння
1. Проаналізуйте зміст уривка літературного твору. Визначте, про які речовини та хімічні реакції йдеться в ньому. Складіть хімічні рівняння: а) процесів, описаних в уривку; б) реакцій за участю речовин, згадуваних у ньому. Класифікуйте хімічні реакції, реагенти й продукти. «Шипить та куриться вапно, що його гасять у великих дощаних скринях». Іван Франко.
2*. Існували досить ефективні способи осушення дачного житла. Наприклад, на підлозі розкладали в плоскі тарілки невеликі шматки негашеного вапна. Убираючи вологу, вапно гаситься й розпадається на порошок. Якщо дача стояла в сирому місці, у низині, доводилося не тільки рятувати кімнати від вогкості, але й створювати гідроізолюваль-ний шар навколо фундаменту. Довкруж будинку викопували рів завширшки 50-70 см, але досить глибокий, що сягав самої підошви фундаменту. Рів пошарово наповнювали негашеним вапном і рослинною золою, яка містила поташ - калій карбонат. Суть процесу полягала в тому, що негашене вапно, поглинувши вологу з ґрунту, підсушувало фундамент і стіни. Змішуючись із золою, перетворювалося на дуже щільний шар - різновид цементу, непроникний для ґрунтової вологи. За допомогою хімічних рівнянь поясніть цю технологію осушування.
3. Неперевершену художню цінність становлять авторські писанки. Найсучасніший метод писанкарства - так зване травлення, коли орнамент обробляється соляною кислотою і опускається нижче загального тла. Це нагадує вишивку білого на білому, адже барв тут здебільшого не застосовують. За допомогою хімічного рівняння поясніть цей метод.
4. Спосіб одержання штучної газованої води відкрито англійським хіміком Джозефом Прістлі. Після експериментів з газом, що виділяється під час шумування в чанах пивоварного заводу, він сконструював апарат, який дає змогу за допомогою насоса насичувати воду «вуглекислими» пухирцями. 1772 року Прістлі продемонстрував свій винахід Колегії фізиків у Лондоні. Назвіть продукт хімічної реакції, яка відбувається унаслідок насичення води вуглекислим газом. Класифікуйте цю хімічну реакцію.
5. Валерій розповів однокласникам, буцімто одного разу після рясного дощу квіти, які росли на лісовій галявині, змінили свій колір з фіолетового на червоний. Марійка сказала, що це вигадки, а Тарас - що така подія цілком імовірна. А як ви вважаєте? Оцініть вірогідність явища, описаного Валерієм.
6. Поясніть, як можна довести наявність лугу в розчинах, що утворилися внаслідок реакцій калію та кальцію з водою.
7. «Луги легко поглинають з повітря водяну пару, вуглекислий газ (карбон(ІУ) оксид), сірчистий газ (сульфур(ІУ) оксид), сірководень (гідроген сульфід). Якщо не вживати запобіжних заходів, луги міститимуть домішки солей». Проаналізуйте наведене застереження й висловіть припущення, яких саме запобіжних заходів потрібно вживати під час зберігання лугів та їхніх розчинів. Назвіть солі, які утворюватимуться внаслідок взаємодії лугів з газами, згадуваними у застереженні. Складіть відповідні хімічні рівняння й класифікуйте хімічні реакції.
8. Здавна в лісистих місцевостях Франції, Німеччини, Богемії виготовляли скло із застосуванням деревної золи та золи папороті, очерету й інших рослин. Ця зола багата на поташ (калій карбонат). У 1764 році професор Петербурзької академії К.Г. Лаксман
під час варіння скла замінив поташ (калій карбонат) натрій сульфатом. Складіть рівняння реакцій, які відбуваються під час сплавляння золи та натрій сульфату з кварцовим піском (силіцій(ІУ) оксидом). Класифікуйте ці хімічні реакції. Оцініть значення винаходу Лаксмана для збереження лісів.
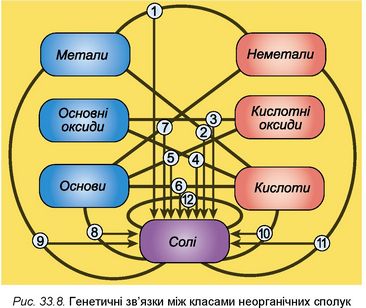
9. Доберіть приклади хімічних рівнянь, які відповідають перетворенням, наведеним на рисунку 33.8. Назвіть реагенти та продукти хімічних реакцій. Класифікуйте хімічні реакції.
Творча майстерня
Складіть сенкан на тему «Основні класи неорганічних сполук».
Дізнайтеся більше:
https://www.youtube.com/watch?v=SmPEmon2hhw https://www.youtube.com/watch?v=hLBSwoHS23s https://www.youtube.com/watch?v=qFy5lX6yHP0
34. Генетичні зв язки між основними класами неорганічних сполук
Жодна наука не потребує експерименту такою мірою, як хімія. Її основні закони, теорії та висновки спираються на факти. Тому постійний контроль дослідом необхідний.
Майкл Фарадей
Після опрацювання параграфа ви зможете:
1установлюватигенетичний зв'язок між простими і складними речовинами, класами неорганічних сполук;
1розв'язуватиекспериментальні задачі;
1висловлюватисудження про значення хімічного експерименту як джерела знань.
Між класами неорганічних сполук існують зв’язки, які називають генетичними. Генетичний (від грец. genesis) - той, що вказує на походження, виникнення, процес утворення. Цей зв’язок полягає в тому, що з речовин одного класу неорганічних сполук можна одержати речовини - представники інших класів. Отже, генетичні зв’язки — це зв’язки між різними класами сполук, які ґрунтуються на їхніх взаємоперетвореннях. До генетичного ряду речовин входять представники різних класів неорганічних сполук одного й того самого хімічного елемента. Вони мають єдине походження — генезис — і пов’язані взаємоперетвореннями.
З наведеного переліку виберіть формули речовин, які належать до генетичного ряду сірки: №, H2O, Na2SO3, АІСІ3, S, Н2Б03, Na3PO4, N2, КОН, SO2, Mg.
Генетичні ряди металів і неметалів. Для металів виокремлюють кілька різновидів генетичних рядів.
1. Генетичний ряд металу, у якому гідратом оксиду металічного елемента є луг. Цей ряд у загальному вигляді можна зобразити такими перетвореннями:
метал —> основний оксид —> луг -» сіль
Наприклад, генетичний ряд літію:
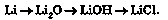
2. Генетичному ряду, в якому гідратом оксиду металічного елемента є нерозчинна основа, відповідає ланцюжок перетворень:
метал -> основний оксид —> сіль -> нерозчинна основа —> сіль —> метал
Зокрема, генетичний ряд міді такий:
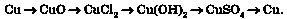
3. Поміж неметалів також можна виокремити два різновиди генетичних рядів. Генетичний ряд неметалів, де ланкою ряду є розчинна оксиге-новмісна кислота. Ланцюжок перетворень такий:
неметал —> кислотний оксид —> розчинна кислота —> сіль
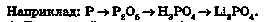
4. Генетичний ряд неметалів, де ланкою ряду є нерозчинна оксигено-вмісна кислота. Ланцюжок перетворень такий:
неметал -> кислотний оксид —> сіль -> нерозчинна кислота -> кислотний оксид
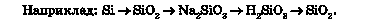
Отже, існують два основних шляхи генетичних зв’язків між неорганічними речовинами: один з них починається металами, другий - неметалами.
Наприклад, кальцій ортофосфат можна одержати шляхом послідовних перетворень з неметалу фосфору та з металу кальцію:
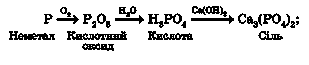
Виконаймо ці досліди (тяга!). Наллємо в товстостінну колбу трохи дистильованої води. Заповнимо колбу киснем витісненням повітря. Підпалимо в ложечці червоний фосфор. Він горить жовтуватим полум’ям. Швидко внесемо його в колбу з киснем і закоркуємо її. Полум’я стає сліпучо-білим. Густий білий дим заповнює колбу. Це частинки фосфор(У) оксиду - продукту згоряння фосфору. Обережно збовтаємо вміст колби. Поступово білий дим зникає - адже фосфор(У) оксид взаємодіє з гарячою водою, утворюючи ортофосфатну кислоту. Щоб пересвідчитися в цьому, за допомогою скляної палички нанесемо кілька крапель одержаного розчину на універсальний індикаторний папірець. Він змінює забарвлення на червоний.
Великий ошурок кальцію акуратно розплющимо молотком у дуже тонкий шар. Візьмемо стружку щипцями, розжаримо розплющений кінчик
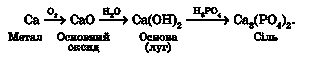
у полум’ї пальника й швидко зануримо в колбу з киснем. Якщо кінчик стружки досить тонкий, метал легко займеться. Кальцій горить характерним цегляно-червоним полум’ям з утворенням білого пухкого порошку кальцій оксиду. Після охолодження в колбу з кальцій оксидом добавимо трохи води, збовтаємо й залишимо на якийсь час. Кальцій оксид прореагує з водою, утвориться завись кальцій гідроксиду. Відфільтруємо завись кальцій гідроксиду й добавимо до фільтрату кілька крапель фенолфталеїну. Розчин набуде малинового забарвлення, тому що кальцій гідроксид - луг.
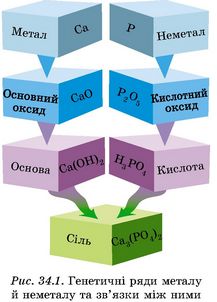
До розчину ортофосфатної кислоти, добутого в попередньому досліді, доллємо розчин кальцій гідроксиду. Утвориться білий осад кальцій ортофосфату, малинове забарвлення фенолфталеїну зникне. Отже, кислота нейтралізувала луг. Усі ці перетворення наведено на рисунку 34.1.
Очевидно, що ця схема не відображає всього розмаїття генетичних зв’язків, бо існують й інші шляхи взаємоперетворень сполук різних класів. Наприклад, кальцій ортофосфат можна добути й у такі способи:
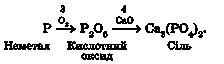
Перетворіть схеми реакцій та їхні фрагменти на хімічні рівняння: Ca + H2O-> Ca(OH)2 + H2T;
Ca(OH)2 + P2O5 ... ;
P + O2 ... ;
P2O5 + CaO —> ... .
Назвіть реагенти й продукти реакцій. Класифікуйте хімічні реакції.
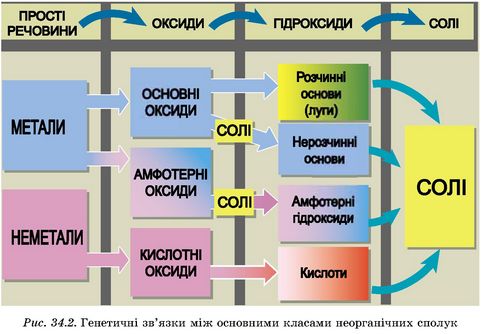
До того ж низка металічних елементів утворює не лише основні, а й амфотерні оксиди й гідроксиди. Тож більш повно різноманітні генетичні зв’язки між основними класами неорганічних сполук описує схема на рисунку 34.2.
Значення експериментального методу в хімії важко переоцінити. Ви змогли пересвідчитися в цьому, намагаючись осягнути класифікацію неорганічних речовин, установити генетичні зв’язки між ними. Цей метод пізнання ґрунтується на контрольованій взаємодії дослідника з об’єктом дослідження в заданих експериментатором умовах. Планують експеримент на основі вихідних ідей, теорій, знань. Експериментатор здобуває інформацію про досліджуваний об’єкт у контрольованих, штучно створених умовах. Саме це відрізняє експеримент від спостереження.
Під час проведення експериментального дослідження об’єкта зазвичай створюють таку ситуацію, коли змінюється лише одна з характеристик або досліджуваного об’єкта, або інструмента дослідження. Це необхідно для того, щоб можна було встановити шукані взаємозв’язки досліджуваних властивостей об’єкта з контрольованими характеристиками експериментальної ситуації. (Поміркуйте й висловіть припущення, чому недоцільно змінювати більше однієї контрольованої характеристики експериментальної ситуації).
Основу пізнання нового у природі становлять експерименти. Їхня мета -установити, чи є в досліджуваного об’єкта певна властивість. Під час їхнього здійснення експериментальну ситуацію організують так, щоб надійно контрольований ефект давав змогу на поставлене Природі запитання одержати відповідь у найпростішій формі «Так» або «Ні». На уроках хімії ставити Природі такі запитання й визначати шляхи пошуку відповідей на них ви будете під час розв’язування експериментальних задач.
Експериментальні задачі - якісні задачі, які розв’язують експериментальним шляхом. Це вид самостійної роботи, у якій учитель лише даватиме вам завдання, а вибір шляху розв’язання й проведення експерименту ви визначатимете самостійно. Тобто активно застосовуватимете не лише теоретичні знання, а й уміння виконувати досліди, передбачати результати.
У процесі розв’язування експериментальних задач ви не лише виконуватимете логічні операції, подібні до тих, які здійснюєте під час розв’язування математичних задач. На вас чекає сходження на новий складний щабель пізнання - перехід від думки до практичних дій. Дуже важливо, щоб практичним діям передувало теоретичне розв’язання. Тоді залишатиметься менше місця для методу спроб (і помилок), ваша діяльність буде більш усвідомленою, а її результат - продуктивнішим.
Розв’язування експериментальних задач має на меті систематичні вправи, пов’язані із застосуванням знань на практиці, а також вироблення експериментальних умінь і навичок, необхідних під час різноманітних досліджень. У такий спосіб ви не лише вдосконалюватимете набуті раніше вміння й навички, але й навчатиметесь застосовувати здобуті знання у знайомих і нових ситуаціях. Цьому сприятиме самостійне знаходження теоретичного розв’язання поставленого завдання з обов’язковою перевіркою дослідним шляхом правильності здобутого результату.
Етапи розв’язування експериментальної задачі такі:
• осмислення умови задачі;
• теоретичне розв’язування задачі, з’ясування умов перебігу реакцій,
їхньої сутності;
• підготовка реактивів і обладнання;
• практичне розв’язування задачі.
Найбільш поширені види експериментальних задач ті, мета яких - добуваннята розпізнаванняречовин. Розгляньмо алгоритми їхнього розв’язування.
Приклад 1. Експериментально здійсніть такі перетворення:
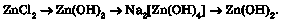
|
Послідовність дій |
Оформлення розв’язання |
|
Теоретична частина |
|
|
Пронумеруйте кожну ланку ланцюга |
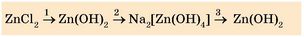 |
|
Складіть рівняння реакцій для кожної ланки ланцюга, ґрунтуючись на знаннях про добування й властивості речовин різних класів |
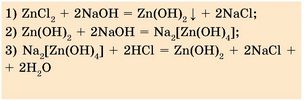 |
|
Перевірте наявність необхідних реактивів, а за їхньої відсутності продумайте інший варіант розв’язання завдання з використанням наявних реактивів |
Замість натрій гідроксиду як реагент можна використати калій гідроксид, а замість однієї кислоти (хлоридної) - іншу (сульфатну) |
|
Продумайте умови перебігу кожної реакції й кількості використовуваних речовин |
До розчину цинк хлориду луг потрібно доливати по краплях, бо якщо долити надлишок лугу, то не утвориться осад цинк гідроксиду, оскільки відразу утвориться розчинна сіль натрій тетрагідроксоцинкат Na2[Zn(OH)4] |
|
Експериментальна частина |
|
|
Здійсніть усі перетворення експериментально й зафіксуйте зміни, що відбуваються з речовинами |
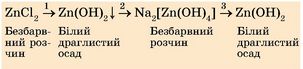 |
|
Приклад 2. Дослідним шляхом визначте, у якій склянці міститься хлоридна кислота, у якій - розчин натрій хлориду, у якій - розчин натрій сульфату. |
|
|
Теоретична частина |
|
|
Проаналізуйте склад кожної речовини й визначте реактиви, необхідні для розпізнавання |
Поміж речовин, які потрібно розрізнити, -одна кислота й дві середні солі. Хлоридна кислота змінює забарвлення індикаторів. Обидві солі містять катіони Натрію, тому їх потрібно розрізняти за аніонами. Щоб розрізнити натрій хлорид і натрій сульфат, потрібно, використовуючи таблицю розчинності, добрати катіон, який утворює розчинний |
|
хлорид і нерозчинний сульфат (або навпаки). Цій умові відповідає катіон Барію. Щоб довести наявність натрій хлориду в розчині, який міститься у третій пробірці, потрібно добрати катіон, який з хлорид-аніо-ном утворює нерозчинну сполуку. Цій умові відповідає катіон Аргентуму(І) |
|
|
Виберіть шлях розв’язання завдання (розпізнавання речовин) |
Складаємо план: а) визначення хлоридної кислоти за допомогою розчину лакмусу; б) визначення розчину натрій сульфату за допомогою розчину барій хлориду; в) доведення наявності натрій хлориду в розчині за допомогою розчину аргентум(І) нітрату |
|
Перевірте наявність необхідних реактивів, а за їхньої відсутності продумайте інший варіант розв’язання завдання з використанням наявних реактивів |
Замість розчину лакмусу можна використати розчин метилового оранжевого або універсальний індикаторний папір. Замість розчину барій хлориду можна використати розчин барій нітрату або розчини кальцій хлориду чи кальцій нітрату. Замість розчину аргентум(І) нітрату можна використати розчин плюмбум(ІІ) нітрату |
|
Експериментальна частина |
|
|
Відберіть проби виданих речовин у чисті пробірки, пронумеруйте їх і добавте в усі пробірки перший реактив. Зафіксуйте спостереження. Зробіть висновок |
У розчині з першої склянки фіолетовий лакмус набув червоного кольору. Отже, у склянці № 1 міститься хлоридна кислота |
|
У чисті пробірки відберіть порції речовин з тих склянок, уміст яких ще не визначено, й добавте другий реактив. Зафіксуйте спостереження. Зробіть висновок |
Унаслідок добавляння розчину барій хлориду до розчину речовини з третьої склянки утворився білий дрібнокристалічний осад. Висновок: у склянці № 3 міститься розчин натрій сульфату |
|
У чисту пробірку відберіть порцію наступної речовини й доведіть, яка це речовина |
Унаслідок добавляння розчину аргентум(І) нітрату до розчину речовини з другої склянки утворився білий сирнистий осад. Висновок: у склянці № 2 міститься розчин натрій хлориду |
|
Зробіть загальний висновок, у якій склянці міститься яка речовина |
Висновок: у першій склянці міститься хлоридна кислота, у другий - розчин натрій хлориду, у третій - розчин натрій сульфату |
Розв’язання експериментальної задачі з розпізнавання речовин можна стисло оформити в такий спосіб:
|
Речо вини |
Реактиви |
|||
|
Розчин лакмусу |
Розчин барій хлориду |
Розчин аргентум(І) нітрату |
Висно вок |
|
|
№ 1 |
Змінив колір на червоний |
- |
- |
HCl |
|
№ 2 |
- |
- |
 |
NaCl |
|
№ 3 |
- |
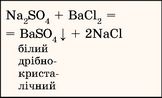 |
- |
Na2SO4 |
Окрім експериментальних задач з добуваннята розпізнаванняречовин, існують й інші типи, метою яких є:
• спостереження фізичних і хімічних явищ і пояснення їхньої суті; класифікація речовин;
• підтвердження якісного складу речовин, характеристика їхніх властивостей;
• визначення домішок у певному об’єкті, пояснення причин вибору певного способу визначення складу сумішей;
• виділення речовини в чистому вигляді із суміші, пояснення причин вибору певного способу розділення суміші;
• проведення характерних реакцій і пояснення типових властивостей речовин;
• виготовлення розчинів речовин з різною масовою часткою й пояснення прийомів їхнього виготовлення.
Ці задачі можуть бути складниками комбінованихекспериментальних задач, розв’язування яких потребує глибоких знань і міцних умінь та навичок.
Для того щоб закріпити знання про експериментальний метод у хімії та вміння розв’язувати експериментальні задачі, виконайте лабораторний дослід.
ЛАБОРАТОРНИЙ ДОСЛІД 9 Розв’язування експериментальних задач

Виконайте за порадою вчителя індивідуально або в малій навчальній групі один з варіантів завдань.
1. Експериментально здійсніть перетворення.
I варіант. Натрій гідроксид натрій сульфат -» натрій хлорид;
II варіант. Купрум(ІІ) сульфат -» купрум(ІІ) гідроксид -» —> купрум(ІІ) нітрат;
2. Дослідним шляхом визначте речовини у пронумерованих склянках.
І варіант. Хлоридна кислота, розчин натрій гідроксиду, розчин натрій хлориду.
ІІ варіант. Розчини сульфатної кислоти, натрій хлориду, натрій сульфату.
Набуті під час лабораторного досліду знання й уміння стануть вам у пригоді на наступних уроках, коли ви виконуватимете практичні роботи, а також у подальшому вивченні хімії та повсякденному житті.
ПРО ГОЛОВНЕ
• Між класами неорганічних сполук існують зв’язки, які називають генетичними.
• Генетичні зв’язки - це зв’язки між різними класами сполук, які ґрунтуються на їхніх взаємоперетвореннях.
• До генетичного ряду речовин входять представники різних класів неорганічних сполук одного й того самого хімічного елемента.
• Вони мають єдине походження - генезис - і пов’язані взаємоперетвореннями.
• Існують два основних шляхи генетичних зв’язків між неорганічними речовинами: один з них починається металами, інший - неметалами.
• В експерименті ми здобуваємо інформацію про досліджуваний об’єкт у контрольованих, штучно створених умовах. Саме це відрізняє його від спостереження.
• Експериментальні задачі - якісні задачі, які розв’язують експериментальним шляхом.
Перевірте себе
1. Що означає термін «генетичний»? 2. Що таке генетичний зв'язок між класами неорганічних сполук? 3. Які ознаки характеризують генетичний ряд? 4. Які є два основних шляхи генетичних зв'язків між неорганічними речовинами? 5. Яке значення експериментального методу в хімії? 6. Які задачі називають експериментальними?
7. Які два типи експериментальних задач найпоширеніші?
Застосуйте свої знання й уміння
1. З наведеного переліку виберіть формули речовин, які належать до генетичного ряду магнію: №, H2O, MgSO4, MgCl2, S, Н2Б03, K3PO4, O2, Мд(ОН)2, SO3, Mg, MgO.
2. Доберіть приклади до схем перетворень:
а) метал + неметал -> сіль;
б) основний оксид + кислотний оксид —» сіль;
в) основа + кислота -> сіль + вода;
г) сіль + кислота -> сіль + кислота;
д) метал + кисень —^ основний оксид;
е) неметал + кисень —^ кислотний оксид;
ж) основний оксид + вода —» луг;
з) кислотний оксид + вода —» кислота; і) кислотний оксид + луг —> сіль + вода;
к) основний оксид + кислота -> сіль + вода.
3. Складіть хімічні рівняння, які відповідають генетичним рядам літію, міді, силіцію (вони наведені в тексті параграфа) та сірки, заліза, алюмінію (їх наведено далі):
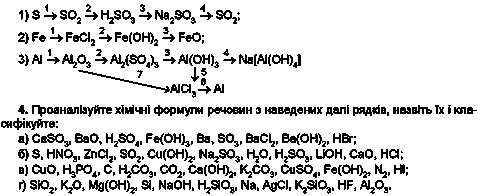
5. Виберіть з кожного рядка (див. завдання 4) формули двоосновних кислот.
6. Виберіть з кожного рядка (див. завдання 4) формулу основного оксиду. Визначте, з якими речовинами, формули яких наведено в рядку, реагуватиме цей оксид. Складіть відповідні хімічні рівняння. Назвіть реагенти і продукти реакцій, класифікуйте хімічні реакції.
7. Виберіть з кожного рядка (див. завдання 4) формулу нерозчинної основи. Визначте, з якими речовинами, формули яких наведено в рядках, реагуватиме ця сполука. Складіть відповідні хімічні рівняння. Назвіть реагенти і продукти реакцій, класифікуйте хімічні реакції.
8. Виберіть з кожного рядка (див. завдання 4) формули оксигеновмісних кислот. Визначте, з якими речовинами, формули яких наведено в рядках, реагуватимуть ці сполуки. Складіть відповідні хімічні рівняння. Назвіть реагенти і продукти реакцій, класифікуйте хімічні реакції.
9. Виберіть з кожного рядка (див. завдання 4) формулу безоксигенової кислоти. Визначте, з якими речовинами, формули яких наведено в рядках, реагуватиме ця сполука. Складіть відповідні хімічні рівняння. Назвіть реагенти і продукти реакцій, класифікуйте хімічні реакції.
10. Виберіть з кожного рядка (див. завдання 4) формулу розчинної основи. Визначте, з якими речовинами, формули яких наведено в рядках, реагуватиме ця сполука. Складіть відповідні хімічні рівняння. Назвіть реагенти і продукти реакцій, класифікуйте хімічні реакції.
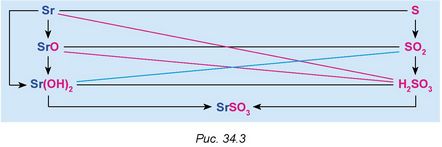
11. Складіть рівняння хімічних реакцій, які відображають генетичні зв'язки всередині генетичних рядів стронцію й сірки та між представниками цих рядів (рис. 34.3).
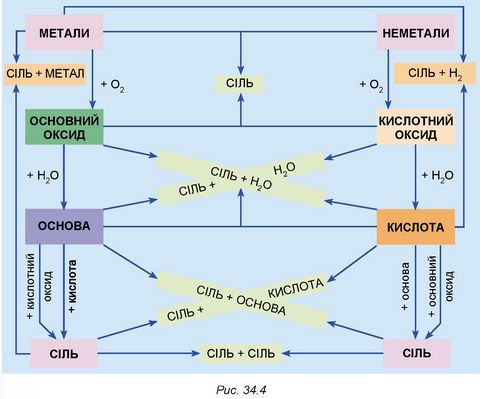
12.* Проаналізуйте рисунок 34.4 й наведіть до нього приклади рівнянь реакцій, зазначте їхні типи.
Творча майстерня
Складіть сенкан на тему «Генетичні зв’язки між основними класами неорганічних
сполук».
Дізнайтеся більше:
http://school-collection.edu.ru/catalog/rubr/d05469b0-69bd-11db-bd13-0800200c9c11/75972/
https://www.youtube.com/watch?v=82ZywNS-8wI
РОЗВ’ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ
Під час виконання цієї роботи ви застосуєте набуті знання про властивості класів неорганічних сполук та взаємозв’язки між ними, удосконалите вміння складати план експерименту й проводити його, робити висновки, розв’язувати експериментальні задачі.
За потреби використайте таблицю розчинності основ, кислот, амфотерних гідроксидів і солей у воді.
Увага! Для ліпшого спостереження використовуйте контрастний екран. Якщо досліди виконуєте у пробірках, беріть по 5 крапель розчинів реагентів.
Якщо дослід виконуєте у заглибинах пластини, то досить узяти по 2—3 краплі розчинів реагуючих речовин.
Будьте особливо обережні під час роботи з їдкими й отруйними речовинами, нагрівальними приладами та скляним хімічним посудом!

Вам видано штатив з пробірками або пластину для крапельного аналізу, скляні палички, піпетки, чорно-білий екран; розчини лугів, кислот, солей, нагрівальний прилад, тримач для пробірок тощо.
Виконайте досліди за порадою вчителя, використовуючи наявні реактиви. Опишіть спостереження й поясніть їх. Складіть відповідні хімічні рівняння. Зіставте мету роботи з одержаними результатами, сформулюйте й запишіть висновок.
1. Дослідним шляхом визначте, у якій з пронумерованих склянок містяться:
а) хлоридна кислота, розчин натрій гідроксиду, розчин натрій хлориду;
б) сульфатна кислота, розчин натрій хлориду, розчин натрій сульфату;
в) розчин купрум(ІІ) сульфату, розчин купрум(ІІ) нітрату;
г) розчин магній сульфату, розчин магній хлориду;
д) кристалічні кальцій карбонат і магній оксид;
е) кристалічні натрій карбонат і натрій нітрат;
ж) розчин алюміній сульфату та розчин натрій сульфату.
2. Експериментально здійсніть такі перетворення:
а) цинк —> цинк сульфат -> цинк гідроксид;
б) натрій карбонат -> натрій сульфат —> натрій хлорид;
в) купрум(ІІ) сульфат —» купрум(ІІ) гідроксид -> купрум(ІІ) хлорид;
г) магній —> магній хлорид —> магній гідроксид —> магній сульфат;
д) калій карбонат -» кальцій карбонат -» карбон(ІУ) оксид;
е) натрій гідроксид -» натрій сульфат -> натрій хлорид -> натрій нітрат;
ж) алюміній хлорид —> алюміній гідроксид —> Na[Al(OH)4] —> алюміній гідроксид —> алюміній сульфат.
3. Добудьте із заліза ферум(ІІ) сульфат.
4. З магній карбонату добудьте магній гідроксид.
5. З розчину сульфатної кислоти, купрум(ІІ) оксиду та заліза добудьте мідь.
6. Доведіть, що до складу мінералу кальциту входить сіль карбонатної кислоти.
7. Здійсніть перетворення: натрій силікат —> силікатна кислота.
8. З калій карбонату добудьте калій гідроксид.
9. Доведіть, що рідкий засіб для видалення накипу містить кислоту.
10*. Визначте, у якій з двох пронумерованих склянок міститься розчин засобу для чищення сантехніки, а в якій - розчин засобу для очищення поверхні плити від жиру.
11. Доведіть за допомогою характерних реакцій, що до складу розпушувача для печива входить сіль карбонатної кислоти. Поясніть, яка властивість цієї солі зумовлює її застосування.
12. Доведіть, що виданий зразок солі «Барбара» містить розчинні сульфати.
13*. З наявних реактивів - купрум(ІІ) оксиду, води, купрум(ІІ) хлориду, розчину засобу для прочищення каналізаційних труб і хлоридної кислоти - добудьте двома способами купрум(ІІ) гідроксид. Укажіть у кожному випадку умови перебігу реакцій.
14. Доведіть, що рідкий засіб для прочищення засмічених каналізаційних труб містить луг.
15. Доведіть, що засіб для прочищення засмічених каналізаційних труб містить сіль карбонатної кислоти.
тестовий контроль знань
1. Лише з формул основних оксидів складається рядок
А SO3, CO2, P2O5 В ВаО, CaO, Na2O
Б SO3, CaO, Cr2O3 Г Al2O3, Cr2O3, ZnO
2. Лише з формул одноосновних кислот складається рядок
А HCl, HNO3, HF, H2S В HCl, HNO3, HF, HBr
Б HNO3, H2S, H2SO3, H2SO4 Г HNO3, H2SO3, HF, HBr
3. Формула основного оксиду, який реагує з водою, - це
А BaO Б SO3 В CuO Г Al2O3
4. Формула оксиду, який реагує з хлоридною кислотою, - це
А CuO Б N2O В CO2 Г SO3
5. Формула оксиду, який реагує з лугом, - це
А NO Б Na2O В CO2 Г CaO
6. Метал, який витісняє водень із хлоридної кислоти, - це
А Cu Б Zn В Au Г Ag
7. Лише з формул лугів складається рядок
А Zn(OH)2, NaOH, KOH В Cu(OH)2, Zn(OH)2, KOH
Б NaOH, KOH, LiOH Г Fe(OH)2, Zn(OH)2, Mg(OH)2
8. За нагрівання розкладається на оксид і воду гідроксид, формула якого
А NaOH Б KOH В Zn(OH)2 Г RbOH
9. Амфотерним і основним оксидами є
А FeO і CaO Б CO2 і CuO В Al2O3 і Na2O Г Fe2O3 і CO
10. Кислотним і основним оксидами є
А SO3 і MgO Б CO2 і Al2O3 В Na2O і FeO Г ZnO і SO2
11. Кислотні властивості найяскравіше виражені в речовини, формула якої
А NH3 Б H2S В HCl Г SiH4
12. Лише з формул кислотних оксидів складається рядок
А CO2, Mn2O7, SO3 В CrO, SO2, CaO
Б Na2O, SiO2, Cr2O3 Г CuO, Al2O3, FeO
13. Кислотні властивості виявляє речовина, формула якої
А PH3 Б CH4 В H2S Г NH3
14. Проаналізуйте твердження й визначте, чи є поміж них правильні.
1. Ochobhmm оксидам відповідають основи.
2. Ochobh оксиди утворюють лише металічні елементи.
А лише перше В обидва правильні
Б лише друге Г немає правильних
15. Ферум(ІІІ) оксид є
А несолетворним Б основним В кислотним Г амфотерним
16. Формула гідрату, який відповідає хром (VI) оксиду, - це
А Cr(OH)2 Б Cr(OH)3 В H2CrO4 Г HCrO2
17. Лише з формул солетворних оксидів складається рядок
А CO2, SO2, N2O, SO3 В NO, As2O5, Br2O5, SO3
Б CO, Cl2O7, P2O3, SO3 Г CO2, SO2, P2O3, SeO3
18. Сіллю є речовина, формула якої
А BaCl2 Б H2O В H2S Г SO2
19. Формули кислотного і основного оксидів записані в рядку
А SO2, MgO Б CO2, Al2O3 В Na2O, FeO Г ZnO, SO3
20. Формули кислотного і основного оксидів записані в рядку
А SO3, Al2O3 Б CO, Na2O В K2O, Fe2O3 Г CrO3, BaO
21. Формули амфотерного гідроксиду й кислоти записані в рядку
А H2SO4, Zn(OH)2 В Ca(OH)2, Be(OH)2
Б KHSO4, NaOH Г Al(OH)3, HNO3
22. Кислотний оксид може утворювати
А Sr Б Ca В Mn Г Cu
23. Сульфур(УІ) оксид реагує з кожною з двох речовин
А H2O, HCl Б O2, CaO В MgO, NaOH Г H2O, Cu
24. Ферум (ІІІ) гідроксид утворюється внаслідок дії розчинів лугів на
А ферум(іі) оксид В розчини солей Феруму(іі)
Б ферум(іІі) оксид Г розчини солей Феруму(Ііі)
25. Ферум(ІІ) хлорид реагує з кожною з двох речовин
А MgO, HCl Б Zn, AgNO3 В HNO3, CO2 Г CaO, CO2
26. У схемі перетворень CaCO3 —» X1 —» X2 + NaCl речовина Х2 - це
А CaSO4 Б CaCl2 В CaO Г Ca(OH)2
+ NaOH + H2SO4 + NaOH
27. У схемі перетворень Fe(NO3)3-> X1 X2-> Fe(OH)3 речовина
ми Х1 і Х2 можуть бути відповідно
А Fe2(SO4)3, Fe2O3 В Fe(NO3)3, Fe2O3
Б FePO4, Fe3O4 Г Fe(OH)3, Fe^SO^
28. Карбон(ІУ) оксид реагує з кожною з двох речовин
А H2O, NaOH В H2O, SO3
Б K2SO4, KOH Г H2SO4, H2
29. Унаслідок прожарювання хром(ІІІ) гідроксиду утворюється вода і
А хром(ІІ) оксид В хром(ІІ) гідроксид
Б хром(Ш) оксид Г хром(Уі) оксид
30. Кальцій нітрат можна добути внаслідок взаємодії
А кальцій оксиду і барій нітрату Б кальцій карбонату і калій нітрату В кальцій гідроксиду і нітратної кислоти Г кальцій ортофосфату і натрій нітрату
31. Розведена сульфатна кислота реагуватиме з
А нікелем Б сріблом В киснем Г міддю
32. Яка з речовин змінює забарвлення індикатора?
А Cu(OH)2 Б KOH В Fe(OH)3 Г Zn(OH)2
33. Яка з речовин реагує з кислотним оксидом?
А Cu(OH)2 Б KOH В Fe(OH)3 Г Zn(OH)2
34. Укажіть рівняння реакції нейтралізації.
А Zn + 2HCl = ZnCl2 + H2 В CaO + H2O = Ca(OH)2
Б 2KOH + H2SO3 = K2SO3 + 2H2O Г 2K + 2H2O = 2KOH + H2
35. Генетичний ряд металу і реактиви правильно зазначені в рядку
А Na —» NaOH Na2O; O2, H2O В K-> K2O-> KOH; O2, H2O
Б Cu CuO —»Cu(OH)2; O2, H2O Г Zn Zn(OH)2 ZnO; O2, H2O
36. Які речовини реагуватимуть між собою?
А O2, SO3 Б Cu(OH)2, O2 В CaO, CO2 Г HCl, Au
37. Для здійснення перетворень за схемою Al(OH)3—> AlCl3—> Al(OH)3необхідно послідовно використати
А хлор і водень
Б натрій хлорид і натрій гідроксид В хлоридну кислоту і натрій гідроксид Г хлоридну кислоту і воду
38. Для здійснення перетворень за схемою P -> P2O5 -> H3PO4—> Ca3(PO4)2необхідно послідовно використати
А кисень, воду, кальцій гідроксид Б воду, натрій ортофосфат, кальцій оксид В кисень, водень, кальцій гідроксид Г воду, натрій ортофосфат, кальцій гідроксид
39. Формула речовини, яку пропущено в ланцюжку перетворень Fe —> X -> -> Fe(OH)2, - це
А FeO Б Fe(NO3)3 В FeS Г FeCl2
40. Формула речовини, яку пропущено в ланцюжку перетворень Cu —» X -» CuCl2, - це
А CuO Б Cu(OH)2 В Cu2O Г CuCO3
41. Схема перетворень E —> E2O3—» E(OH)3 FCl3відповідає генетичному ряду
А натрій —> натрій оксид —» натрій гідроксид -» натрій хлорид Б алюміній —> алюміній оксид —» алюміній гідроксид -> алюміній хлорид В кальцій -» кальцій оксид —» кальцій гідроксид —> кальцій хлорид Г сірка —> сульфур(М) оксид —> сульфітна кислота —> натрій сульфіт
42. Схема перетворень E —> E2O -> ЕОН -> ECl відповідає генетичному ряду
А натрш -» натрій оксид -> натрій гідроксид —> натрій хлорид Б алюміній -> алюміній оксид алюміній гідроксид —> алюміній хлорид В кальцій -> кальцій оксид -> кальцій гідроксид —> кальцій хлорид Г сірка —> сульфур(І^ —» сульфітна кислота -> натрій сульфіт
43. Схема перетворень E —> EO ^ E(OH)2^ E(NO3)2відповідає генетичному ряду
А натрш -> натрій оксид -> натрій гідроксид —> натрій хлорид Б алюміній -> алюміній оксид —> алюміній гідроксид —» алюміній хлорид В кальцій —> кальцій оксид -> кальцій гідроксид —> кальцій нітрат Г сірка —> сульфур(І^ оксид —> сульфітна кислота -> натрій сульфіт
44. Схема перетворень E —> ЕО2 —» Н2ЕО3 -> Na2EO3 відповідає генетичному ряду
А натрій —> натрій оксид -» натрій гідроксид -> натрій хлорид Б алюміній -» алюміній оксид -> алюміній гідроксид -> алюміній хлорид В кальцій -> кальцій оксид —> кальцій гідроксид —> кальцій нітрат Г сірка —> сульфур(ІУ) оксид -> сульфітна кислота -» натрій сульфіт
45. Генетичний зв’язок - це зв’язок між речовинами
А різних класів, утворених одним хімічним елементом, пов'язаними взаємоперетвореннями, і відображує єдність їхнього походження Б різних класів, утворених одним хімічним елементом, пов'язаних взаємоперетвореннями, і відображує відмінність їхнього походження В однакових класів, утворених різними хімічними елементами, пов'язаних взаємоперетвореннями, і відображує єдність їхнього походження Г речовинами однакових класів, утворених одним хімічним елементом, пов'язаних взаємоперетвореннями, і відображує єдність їхнього походження
Домашній експеримент
1. Дослідження фізичних властивостей речовин з різними типами кристалічних ґраток: води, кухонної солі, піску.
Виберіть крупні кристалики кам’яної солі. Заморозьте кілька кубиків льоду. Приготуйте порцію кварцового піску10. За допомогою сильної лупи розгляньте кристалики речовин. Перевірте, чи є в них запах.
Порівняйте твердість цих речовин. Спробуйте подряпати кристаликами скляну пластинку, подрібнити їх молотком. УВАГА! Захистіть очі й руки, щоб не поранити їх гострими скалками.
Використовуючи пластикові одноразові стаканчики, перевірте, чи розчиняються кухонна сіль і кварцовий пісок у воді. У якої з цих речовин найнижча температура плавлення й кипіння? Чому?
Опишіть свої спостереження й зробіть висновок за результатами дослідження.
2. Дія на сік буряка лимонного соку, розчину харчової соди, мильного розчину.
У три одноразові пластикові стаканчики налийте лимонного соку, розчину харчової соди, мильного розчину. Добавте в кожний зі стаканів трохи свіжовичавленого соку червоного буряка. Опишіть свої спостереження й зробіть висновок за результатами дослідження
Навчальні проекти
1. З історії відкриття періодичної системи хімічних елементів.
2. Форми періодичної системи хімічних елементів.
3. Залежність фізичних властивостей речовин від типів кристалічних ґраток.
4. Сполуки основних класів у будівництві й побуті.
5. Хімічний склад і використання мінералів.
6. Вирощування кристалів солей.
7. Вплив хімічних сполук на довкілля і здоров’я людини.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:21, Переглядів: 12536