§ 38. Генетичні зв’язки між основними класами неорганічних сполук
Опанувавши матеріал параграфа, ви зможете:
• знати, між якими речовинами існують генетичні зв’язки;
• уміти складати схеми перетворень речовин; складати рівняння реакцій, що лежать в основі схем;
• пояснювати генетичні зв’язки між простими речовинами ii речовинами, що утворюють основні класи неорганічних сполук.
Генетичні зв’язки між класами неорганічних сполук. Вивчаючи хімічні властивості основних класів неорганічних сполук, ви дізналися, що під час хімічних перетворень з речовин одного класу утворюються речовини інших класів. Це ще один доказ того, що між простими й складними речовинами та між основними класами неорганічних сполук існують взаємозв’язки. їх називають генетичними {від грецьк. генезис походження).
У хімії генетичні зв’язки зображають у вигляді ланцюжків перетворень. Розглянемо це па конкретному прикладі:
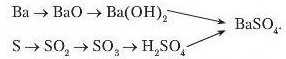
У наведеному ланцюгу перетворень подано два ряди генетично пов'язаних речовин. Перший починається металом, другий неметалом. Починаючи з металу барію, через ряд перетворень добувають барій сульфат. Однак цю сіль можна добути через низку перетворень, починаючи від неметалу сірки.
Можливі схеми генетичного зв'язку від складніших до простіших за складом речовин і знову до складніших. Наприклад:
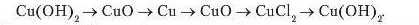
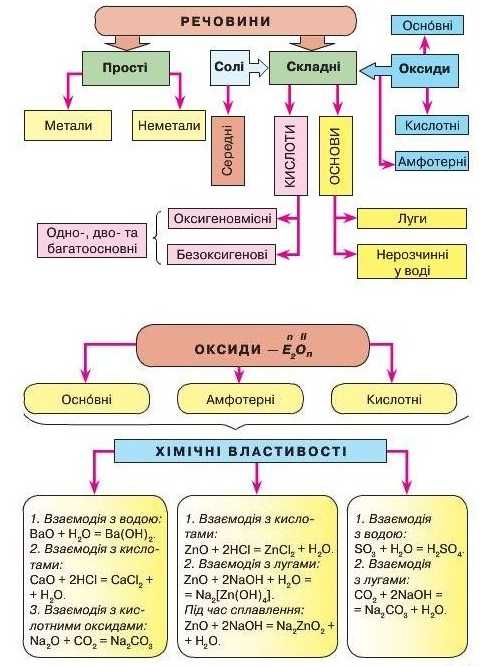
Генетичні зв’язки між простими і складним речовинами та класами неорганічних речовин у загальному вигляді подано схемою па рисунку 89.
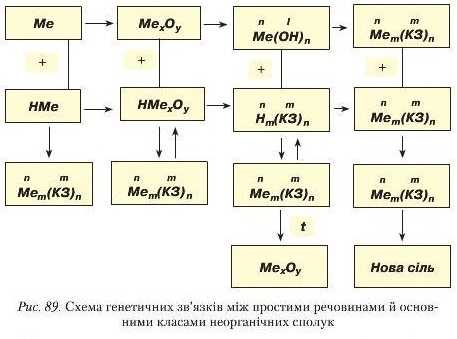
Розгляньте уважно подану схему по вертикалі та горизонталі. У горизонтальних рядках показано перетворення металів (перший ряд) через основний оксид і гідроксид (основу) до солі. У другому ряді перетворення неметалів через кислотний оксид і гідроксид (кислоту) до солі.
У вертикальних стовпцях показано взаємоперетворення речовин, що утворюють основні класи неорганічних сполук.
Треба зазначити, що знання про генетичні зв'язки між класами речовин, уміння здійснювати їх взаємоперетворення має практичне значення в хімічній промисловості. Це створює певні умови для добування нових, невідомих сполук, які люди використовують у різних галузях господарської діяльності.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Між простими речовинами, простими й складними речовинами існують взаємозв’язки, що називають генетичними.
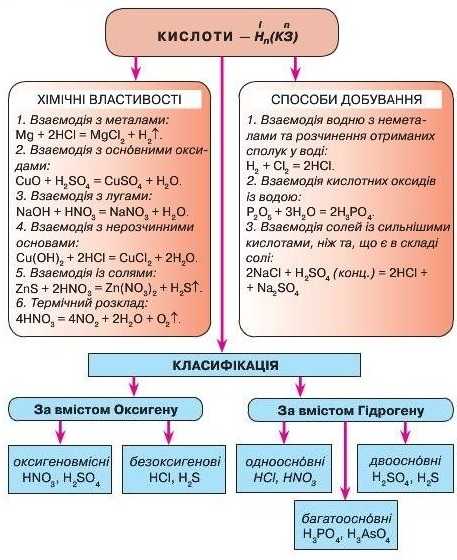
• Найчастіше генетичні ряди починаються простими речовинами (металами чи неметалами) і через низку перетворень — оксиди (ОСН0ВНІ, кислотні), гідрати оксидів (основи, кислоти) — утворюють солі.
• Генетичні ряди відображають не тільки взаємоперетворення від простої до складних речовин, а й між складними речовинами.
• Знання про генетичні зв’язки між класами речовин, уміння здійснювати їх взаємоперетворення має практичне значення під час виконання лабороторних дослідів і добування речовин у промисловості.
ЗАВДАННЯ ДЛЯ САМОКОН ТРОЛЮ
1. Назвіть два генетичні ряди речовин.
2. Напишіть рівняння реакцій за поданими схемами:
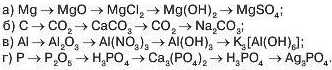
3. иульфатну кислоту масою іу,о г повністю нейтралізували розчином калій гідроксиду. Обчисліть маси продуктів реакції.
4. Напишіть, використовуючи формули, схему генетичних зв'язків і рівняння відповідних реакцій:
а) натрій хлорид -» хлоридна кислота -» купрум(ІІ) хлорид -> -» купрум(ІІ) гідроксид -» купрум(ІІ) оксид -» купрум(ІІ) нітрат;
б) ферум -»ферум(ІІ) сульфат->ферум(ІІ) гідроксид ->ферум(ІІ) оксид -> ферум(ІІ) хлорид;
в) сірка -> сульфур(ІУ) оксид -> сульфур(УІ) оксид -» сульфатна кислота -> купрум(ІІ) сульфат (двома способами);
г) кальцій -> кальцій оксид-> кальцій гідроксид -> кальцій карбонат карбон(І\/) оксид -> натрій карбонат.
5. Доведіть експериментально, що до складу:
а) алюміній сульфату входять йон Алюмінію та кислотний залишок сульфатної кислоти (сульфат-аніон);
б) магній хлориду — йон Магнію та кислотний залишок хлорид-ної кислоти (хлорид-аніон).
6. Запропонуйте спосіб розпізнавання:
а) хлоридної та сульфатної кислот;
б) солей хлоридної та сульфатної кислот.
НАВЧАЛЬНИМ UPOfKT
I. Оберіть самостійно або з допомогою вчителя тему навчального
проекту з тих, що подані нижче.
1. Сполуки основних класів у будівництві й побуті.
2. Хімічний склад і використання мінералів.
3. Вирощування кристалів солей.
4. Вплив хімічних сполук на довкілля і здоров 'я людини.
II. Виконайте навчальний проект в обраній вами формі.
III. Проведіть презентацію проекту.
ПРАКТИЧНІ РОБОТИ Практична робота 1
ДОСЛІДЖЕННЯ ВЛАСТИВОСТЕЙ ОСНОВНИХ КЛАСІВ
НЕОРГАНІЧНИХ СПОЛУК
Ви вже ознайомлені з експериментальним методом, за допомогою якого вивчають та описують властивості речовин, способи їх добування, застосування.
Мета роботи:підтвердити знання властивостей оксидів, кислот, основ і солей; формувати вміння й навички експериментального вивчення властивостей речовин; спостерігати ознаки перебігу реакцій; складати рівняння реакцій, що підтверджують властивості речовин; робити висновки.
Завдання практичної роботи
I варіант
1. Проведіть дослідження, яке підтверджує, що кальцій оксид є основним, а не кислотним.
2. Дослідіть взаємодію хлоридиої кислоти з: а) магнієм; б) розчином кальцій гідроксиду.
3. Доведіть експериментально, що натрій гідроксид взаємодіє з Kapooii(IV) оксидом. Поясніть результати дослідження.
4. Проведіть реакцію обміну .між розчинами натрій сульфату та барій хлориду. Поясніть, чи відбулася реакція до кіпця.
II варіант
і. Проведіть реакцію, яка підтверджує, що карбон(IV) оксид є кислотним, а не основним.
2. Дослідіть взаємодію сульфатної кислоти з: а) кальцій оксидом; 6) свіжодобутим куирум(ІІ) гідроксидом.
3. Доведіть експериментально, іцо нерозчинні у воді основи розкладаються за нагрівання.
4. Проведіть реакцію обміну між розчинами магній хлориду й аргеитум(І) нітрату. Поясніть, чи відбулася реакція до кінця.
III варіант
1. Проведіть реакцію між натрій гідроксидом і нітратною кислотою. Поясніть, як спостерігати перебіг реакції.
2. Доведіть експериментально, що в повітрі, яке видихає людина, міститься вуглекислий газ.
3. Дослідіть взаємодію сульфатної кислоти з: а) розчином барій гідроксиду; б) цинком. Поясніть результати дослідження.
4. Проведіть реакцію обміну між розчином ферум(ІІ) хлориду та калій гідроксидом. Поясніть, чи відбулася реакція до кінця.
IV варіант
1. Доведіть, що видана вам речовина є хлоридиою кислотою.
2. Дослідіть взаємодію хлоридиої кислоти з: а) розчином аргентум(І) нітрату; б) залізом.
3. Доведіть експериментально, що кальцій гідроксид є лугом.
4. Проведіть реакцію обміну між розчинами цинк хлориду й натрій гідроксиду. Поясніть, чи відбулася реакція до кінця.
Практична робота 2
РОЗВ'ЯЗУВАННЯ ЕКСПЕРИМЕНТАЛЬНИХ ЗАДАЧ
Сама назва «експериментальна задача» підкреслює специфіку виконання цього виду роботи, а саме: такі задачі розв'язуються досліді і им IIL1Iя хом.
Мета роботи: навчитися розпізнавати речовини, встановлювати їх якісний склад; добувати речовини й досліджувати їх хімічну природу; робити висновки.
Завдання практичної роботи
І варіант
1. У трьох пробірках під шифрами є розчини: барій хлориду, калій хлориду та нітратної кислоти. Визначте експериментально кожну з цих речовин.
2. Вам видано порошки магнію й магній оксиду. Запропонуйте два способи добування магній сульфату. Ваші пояснення підтвердіть екснери меі пал ьі ю.
3. Доведіть, що до складу аргентум(І) нітрату входить йон Ap ге нтум у Ag+.
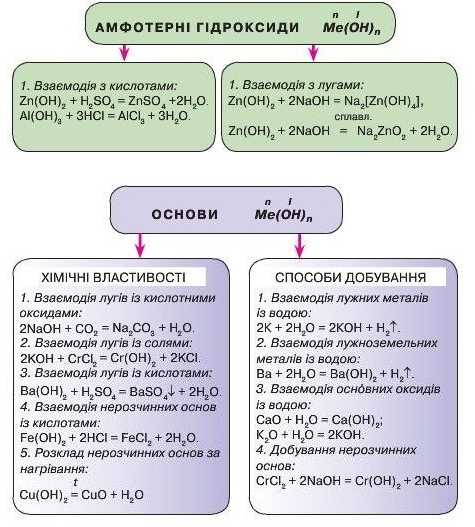
4. Добудьте алюміній гідроксид і доведіть його подвійну хімічну природу.
II варіант
1. У трьох пробірках під шифрами є розчини: натрій гідроксиду, аргентум(ї) нітрату й ортофосфатної кислоти. Визначте експериментально кожну з цих речовин.
2. Вам видано порошки магнію, заліза та міді й хлоридну кислоту. Проведіть дослідження, які характеризують взаємодію кислот із металами.
3. Доведіть, щодо складу купрум(П) сульфату входить йон Кунруму Cu2'.
4. Добудьте цинк гідроксид і доведіть його подвійну хімічну природу.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
Заповнивши вертикальні стовпці, отримаєте назву речовин, що проявляють подвійну хімічну природу.
1. Одна з умов перебігу реакцій до кінця.
2. Одна з фізичних характеристик речовин.
3. Назва речовин, до складу яких входить сульфат-аніон.
4. Речовини, що складаються з атомів одного хімічного елемента.
5. Речовини, що змінюють забарвлення лакмусу на червоне.
6. Зв'язки між класами речовин.
7. Елемент, що утворює нестійку кислоту.
8. Речовини, до складу яких входять гідроксид-аніони.
9. Продукти реакцій нейтралізації.
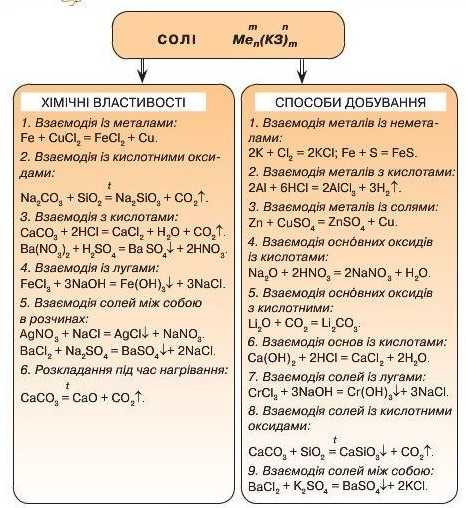
УЗАГАЛЬНЕННЯ ЗНАНЬ ІЗ ТЕМИ 4
* ОСНОВНІ КЛАСИ НЕОРГАНІЧНИХ СПОЛУК>
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 19-09-2016, 00:13, Переглядів: 5209