Йони. Йонный зв'язок, його утворення
Тільки той досягає мети, хто іде.
Олександр Олесь
Після опрацювання параграфа ви зможете:
• наводити прикладисполук з йонним хімічним зв'язком;
• пояснюватиутворення йонного зв'язку;
• характеризуватийого особливості.
Йони - це заряджені частинки, на які перетворюються атоми і молекули внаслідок приєднання або втрачання одного або кількох електронів.
Якщо електронейтральна частинка приєднує електрони, вона перетворюється на негативний йон - аніон. Цей процес супроводжується виділенням енергії. Натомість утворення катіона - позитивного йона - відбувається внаслідок втрачання електронейтральною частинкою електронів. Під час цього процесу енергія поглинається. Протилежно заряджені йони притягуються, між ними виникає йонний зв’язок.
Поняття і термін «йон» увів у 1834 році англійський науковець Майкл Фарадей (рис. 13.1). У перекладі з давньогрецької uW - той, що йде. Аніон - той, що йде вгору, катіон - той, що йде вниз.
 |
Рис. 13.1. Фарадей Майкл (1791-1867). Англійський науковець. Навчався самотужки, наукові дослідження почав у галузі хімії. Зробив вагомий внесок у розвиток хімічного аналізу, синтетичної органічної хімії, металургії, уперше отримав низку газів у зрідженому стані. Установив кількісні закони електролізу. Увів терміни «йон», «катіон», «аніон», «електрод», «електроліт», поняття діелектричної проникності. Досліджував електромагнетизм, створив учення про електромагнітне поле. Член багатьох академій наук і наукових товариств |
Йонний зв’язок - це зв’язок між катіонами та аніонами. Його можна розглядати як граничний випадок ковалентного полярного зв’язку. Якщо різниця в значеннях електронегативності атомів хімічних елементів дуже велика, спільні електронні пари практично повністю зміщуються до атома більш електронегативного елемента. За цих умов атоми перетворюються на йони. Розгляньмо утворення йонного зв’язку у кристалі натрій хлориду.
Атом Натрію втратив один електрон і перетворився на катіон Na+. Це стійка частинка, адже після втрачання електрона має завершений зовнішній другий рівень, такий як в атома Неону: 1s22s22p6.
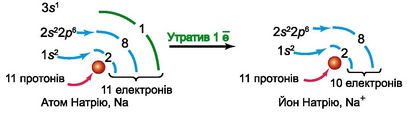
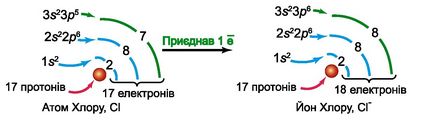
Атом Хлору приєднав один електрон і перетворився на аніон Cl-. Це також стійка частинка. Адже в атомі Хлору на зовнішньому енергетичному рівні було сім електронів, а після приєднання електрона рівень набув завершеності, як атом Аргону: 1s22s22p63s23p6.
За рахунок електростатичних сил притягання між катіонами Натрію та аніонами Хлору утворюються йонні зв’язки у кристалі натрій хлориду (рис. 13.2).
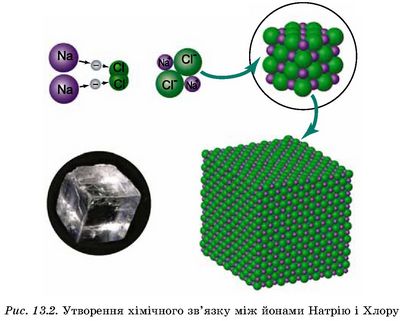
Зверніть увагу: у кристалі натрій хлориду катіон Натрію з усіх боків оточений аніонами Хлору і навпаки. Енергетично найбільш вигідно, коли кожен йон оточений максимальним числом йонів протилежного знака. Однак через відштовхування однойменних йонів один від одного стійкість системи досягається лише за певного взаємного розташування йонів. Наприклад, у натрій хлориді кожен катіон оточений шістьма аніонами і навпаки.
Запам’ятайте: на катіони перетворюються атоми металічних елементів, на зовнішньому енергетичному рівні яких зазвичай не більше трьох електронів. На аніони перетворюються атоми неметалічних елементів (за винятком інертних), на зовнішньому енергетичному рівні яких - від чотирьох до семи електронів. Атом Гідрогену може утворити як катіон, так і аніон.
Запишіть електронну формулу атома Гідрогену. Визначте, скільки протонів і електронів у його катіоні та аніоні.
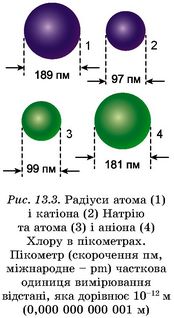
Зверніть увагу: радіуси йонів відрізняються від атомних радіусів відповідних хімічних елементів. Утрачання атомами електронів зумовлює зменшення їхніх ефективних розмірів, а приєднання електронів - збільшення. Тому радіус катіона завжди значно менший, а радіус аніона завжди трохи більший за радіус атома (рис. 13.3). У межах головної підгрупи радіуси йонів однакового заряду, як і радіуси атомів, зростають зі збільшенням протонного числа (рис. 13.4).

Межа між ковалентним полярним та йонним зв’язком дещо умовна. Різниця електронегативності хімічних елементів дає змогу визначити, наскільки хімічний зв’язок у сполуці відрізняється від ковалентного неполярного. Для ковалентного неполярного зв’язку різниця значень електронегативності дорівнює нулю або дуже близька до нуля. Якщо величина Д% менша за 0,4, такий зв’язок теж умовно називають «неполярним ковалентним». За різниці електронегативності від 0,4 до 2,0 зв’язок уважають полярним ковалентним. За різниці значень електронегативності понад 2,0 зв’язок уважають йонним.
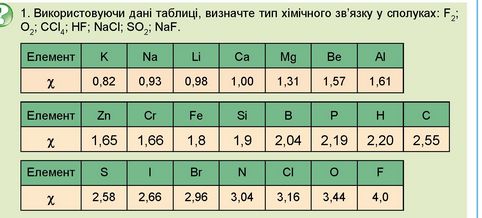
2. Порівняйте ковалентний неполярний, ковалентний полярний та йонний зв'язки (рис. 13.5). Зверніть увагу: літерою 5 позначено часткові електричні заряди на атомах у молекулі гідроген хлориду.
ПРО ГОЛОВНЕ
• Йонний зв’язок - це зв’язок між катіонами та аніонами.
• Межа між ковалентним полярним та йонним зв’язком дещо умовна.
• Різниця значень електронегативності хімічних елементів дає змогу визначити, наскільки хімічний зв’язок у сполуці відрізняється від ковалентного неполярного.
Перевірте себе
1. Що таке йони? 2. Як утворюються катіони? Аніони? 3. Який зв'язок називають йонним? 4. Чи є чітка межа між ковалентним полярним і йонним зв'язком? 5. Як визначити, наскільки хімічний зв'язок у сполуці відрізняється від чисто ковалентного?
Застосуйте свої знання и уміння
1. У якому рядку наведено формули трьох речовин з йонним типом хімічного зв'язку?
А K2O, Na2S, LiCl В H2SO4, CO2, Cl2
Б MgO, H2O, H2S Г MgO, SO2, NH3
2. На прикладі реакції літію з фтором розгляньте утворення йонного зв'язку в літій флуориді.
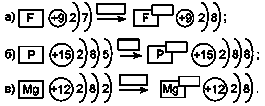
3. Доповніть схеми утворення йонів: зазначте в прямокутнику над стрілкою, скільки електронів віддано або прийнято, у прямокутнику біля символу йона - його заряд.
4. У йоні якого хімічного елемента вдвічі більше електронів, ніж в атомі Флуору?
5. Наведіть приклади атома, катіона й аніона, будова електронної оболонки в яких така сама, як в аніона Сульфуру.
6. *Не використовуючи довідкових даних, спрогнозуйте зміну радіуса частинок за таких перетворень: a) P5+ —» P3+ -> P —» P3-; б) C4- -> C —» С4+. Відповідь обґрунтуйте.
Творча майстерня
Класифікуйте речовини повсякденного вжитку за типом хімічного зв’язку, підготуйте презентацію свого дослідження.
Це матеріал з підручника Хімія 8 клас Лашевська
Автор: admin от 21-10-2016, 03:02, Переглядів: 9587