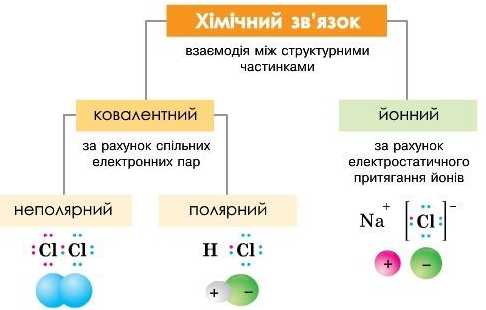
Йонний зв’язок
Як утворюються хімічні зв'язки між атомами металічних і неметалічних елементів?
Ви добре знаєте речовину, про яку ніде мова. Останнім часом стало модно відмовлятися від її вживання, ніби вона «білий ворог». А колись ця речовина заміняла гроші й була причиною нечуваних «соляних» бунтів.
Мова йде ііро натрій хлорид NaCl — кухонну сіль.
У давнину Таврійським степом чумаки но сіль у Крим ходили. Вдень вони но сонцю дорогу знаходили, а вночі — по зірках. Ще й досі ті зоряні гони на небі люди Чумацьким Шляхом звуть (мал. 44, мал. 45).

Натрій хлорид NaCl утворений атомами металічного та неметалічного елементів.
На зовнішньому енергетичному рівні атом Натрію має лише один валентний електрон, атом Хлору — 7 електронів, один з яких неснарений. За рахунок не-сиарених електронів між цими атомами може утворитись зв’язок. Але велика різниця електронегативностей атомів металічних і неметаїічних елементів обумовлює інший механізм утворення хімічного зв’язку. Для NaCl ця різниця електронегативностей складає 1,7.
Електрон атома Натрію зміщується до більш електронегативного атома Хлору, і, можливо, переходить на його зовнішній енергетичний рівень, тобто атом Натрію віддає свій електрон атому Хлору. Обидва набувають стійкої 8-електронної конфігурації зовнішнього енергетичного рівня.
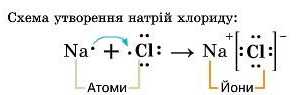
При цьому атоми перетворюються на йони: атом Натрію на позитивно заряджений йон Na*, атом Хлору — негативно заряджений йон Cl".
Атом Натрію електронейтральний, оскільки кількість протонів та електронів у атомі однакова. Коли атом втрачає електрон, заряд змінюється. Математично це можна виразити таким чином:
0-(-1 електрон) = 1+
Заряд йона Натрію 1+.
Поміркуйте! Доведіть математично, що йон Хлору має негативний заряд (1-).


Позитивно заряджені йони називають катіонами
Негативно заряджені йони називають аніонами
Утворені протилежно заряджені йони притягаються за рахунок електростатичної взаємодії. При цьому утворюється йонна сполука.
Зв’язок у йонних сполуках обумовлюється не спільною електронною парою, а силою електростатичноію протягування йонів.
Йонний зв’язок — це хімічний зв'язок, що реалізується за рахунок електростатичної взаємодії між протилежно зарядженими йонами.
Природа ковалентних та йонного зв’язків обумовлюється взаємодією ядер атомів та електронів зовнішнього шару. Експериментально доведено, що повний перехід електронів від атомів металічних елементів до атомів неметалічних елементів відбувається не завжди. Тому заряди, що виникають на катіоні Натрію та аніону Хлору, наближаються до одиниці.
Формально вважають, якщо різниця електронега-тивностей більше за 2,1 — це йонний зв’язок. Його можна вважати крайнім випадком ковалентного полярного зв’язку. Виключно йонного зв’язку практично не існує. Отже, поділ на ковалентний полярний і йонний зв’язки — умовний. Проте слід зазначити, що є й певні відмінності, наприкад, йонні зв’язки міцніші, ніж ковалентні.
Атоми металічних елементів, що мають від 1 до З електронів на зовнішньому енергетичному рівні й порівняно великі радіуси, легко втрачають електрони:
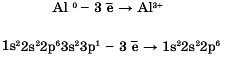
Наприклад, атом Алюмінію Al0 перетворюється на катіон Al3*
Електронні конфігурації атома та йона
Атоми неметалічних елементів, за винятком інертних газів, мають від 4 до 7 електронів на зовнішньому енергетичному рівні та порівняно невеликий радіус. Вони здатні скоріше приєднувати електрони і перетворюватися на негативно заряджені йони:
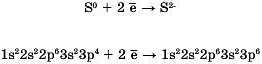
Наприклад, атом Сульфуру S0 перетворюється на аніон S2-Електронні конфігурації атома та йона
Пам’ятайте!
• Що лівіше і нижче розміщено елемент у періодичній системі, то легше його атоми втрачають електрони і перетворюються на катіони.
• Що правіше і вище розміщено елемент у періодичній системі, то сильніше його атоми притягують електрони й перетворюються на аніони.
• Якщо атоми перетворюються на йони, різко змінюються їхні розміри, а тому і властивості.
• Заряд йона позначають верхнім індексом праворуч від символа елемента із зазначенням заряду «+» або «-» після цифри (величини заряду).
За схемою дайте характеристику типам хімічного зв'язку та наведіть по кілька прикладів сполук.
1. Чим обумовлено виявлення атомами металічних чи неметалічних властивостей елементів?
2. Охарактеризуйте механізм утворення йонних сполук.
3. Обґрунтуйте, чому поділ на ковалентний і йонний зв'язки умовний.
4. Запишіть електронні конфігурації йонів Натрію та Хлору. Вкажіть, атоми яких інертних газів мають такі самі електронні конфігурації (позначте символами під відповідними формулами).
5. Порівняйте будову йонів Флуору, Літію й Берилію з будовою атома Неону.
6. Складіть схеми перетворення атомів Магнію, Цинку, Феруму, Нітрогену, Йоду на можливі йони.
7. Складіть схеми утворення та електронні формули йонних сполук: Li2S, PbO2, CuF21 NaH.
8. Враховуючи будову атома та положення у періодичній системі елементів Фосфору та Хлору, спрогнозуйте тип зв'язку у сполуці та склад її молекули.
9. Встановіть подібність та відмінність між зв'язками у сполуках: гідроген фторид та натрій фторид.
10. Встановіть відповідність між типами зв'язку та формулами сполук.
А ковалентний неполярний зв'язок 1 H2 5 AICI3
Б ковалентний полярний зв’язок 2 LiF 6 NH3
В йонний зв'язок 3 SiO2 7 S8
4 CI2O7 8 CS2 9 Na2S
Це матеріал з підручника Хімія 8 клас Василенко
Автор: admin от 21-10-2016, 21:50, Переглядів: 3940