§ 40. Розрахункові задачі: виведення найпростіших формул речовин за даними кількісного аналізу
У цьому параграфі ви дізнаєтеся:
• як скласти найпростішу формулу речовини за даними кількісного аналізу.
Найпростіші формули показують відносне (а не істинне) найменше співвідношення чисел атомів різних елементів у певній речовині. Щоб знайти істинну формулу цієї речовини, потрібно знати її молярну масу.
Розглянемо декілька прикладів виведення найпростіших формул на підставі даних кількісного аналізу. Нагадаємо, що під кількісним аналізом слід розуміти кількісне визначення вмісту атомів будь-яких елементів, що входять до складу речовини, або співвідношення чисел атомів цих елементів.
І Приклади розв’язування задач Приклад 1. Знайдіть найпростішу формулу речовини, до складу якої входить Сульфур з масовою часткою 40 % та Оксиген з масовою часткою 60 %.

Приклад 2. Масові частки Гідрогену, Нітрогену й Оксигену в кислоті дорівнюють відповідно 2,13 %, 29,79 % і 68,08 %. Визначте найпростішу формулу кислоти та її молярну масу.

І Запитання та завдання
0 1. Що розуміють під кількісним аналізом речовини?
° 2. На що вказує найпростіша формула речовини?
3. Що обов’язково потрібно знати, щоб на підставі найпростішої формули речовини знайти її істинну формулу?
° 4. Якою буквою позначають масову частку елемента в речовині? На що вказує масова частка?
5. Найпростішу формулу сульфіду лужного елемента, у якому масова частка Сульфуру становить 15,76 %, можна подати таким чином:
a) Na2S; б) K2S; в) Li2S; г) Rb2S.
6. Найпростішою формулою речовини, у якій масові частки Сульфуру та Флуору дорівнюють 21,9 % і 78,1 %, є:
a) SF; б) SF1; в) SF5; г) SF6.
7. Елемент E із масовою часткою 18,42 % входить до оксиду, склад якого має найпростішу формулу E2O3. Цей елемент має назву:
а) Бор; б) Ферум; в) Нітроген; г) Манган.
8. Найпростішою формулою нітроген оксиду, у якому масова частка Нітрогену в 1,75 раза більша за масову частку Оксигену, є:
a) N2O5; б) N0; в) NO2; г) N2O.
* 9. Узято порцію речовини масою 100 г, у якій масова частка Феруму становить 72,4 %, решта — Оксиген. Скільки атомів Феруму містить найпростіша формула речовини?
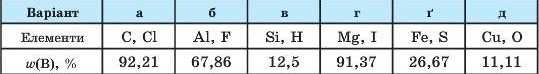
* 10. Складіть найпростіші формули двоелементних сполук складу E^By та обчисліть їхні молярні, а де потрібно — формульиі маси за такими даними:
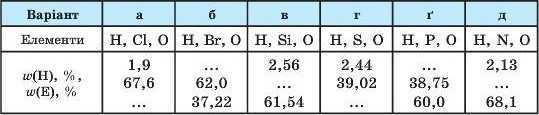
11. Складіть найпростіші формули триелементних сполук складу HfEyOi і обчисліть їхні молярні маси за такими даними:
* 12. Деякий елемент в оксиді, де його масова частка складає
50 %, виявляє валентність, що дорівнює IV. Яка найпростіша формула цього оксиду та назва елемента, що його утворює?
* 13. Унаслідок розкладання 20 г деякої солі за температури
1000 °С утворилося 4,48 дм3 (и. у.) карбон(ГУ) оксиду CO2 та 0,2 моль кальцій оксиду CaO. Якою є найпростіша формула та формульна маса цієї солі?
14. Складіть найпростішу формулу речовини, яка містить (за масою) 43,4 % Натрію, 11,3 % Карбону та 45,3 % Окси-гену.
15. Речовина містить (за масою) 26,53 % Калію, 35,37 % Хрому, 38,10 % Оксигену. Складіть її найпростішу формулу.
Тестові завдання
Відповіді на завдання, наведені у вигляді тестів, нададуть вам можливості самостійно перевірити рівень засвоєння матеріалу попередніх параграфів.
1. Найменшу масу має 1 моль речовини:
a) MnO2; б) SO2; в) CO2; г) NO2.
2. У порції кальцій карбонату масою 45 г міститься кількість речовини, що дорівнює:
а) 0,65 моль; б) 0,45 моль; в) 0,85 моль; г) 0,25 моль.
3. У порції ортофосфатної кислоти масою 24,5 г число структурних частинок складає:
а) 1,505-IO23; б) 6,02-IO23;
в) 3,01 - 1023; г) 4,515 -IO23.
4. Молярний об’єм будь-якого газу за нормальних умов дорівнює:
а) 6-Ю23 г/моль; б) 22,4 г/моль;
в) 6-1023 дм8/моль; г) 22,4 дм3/моль.
5. Середня молярна маса повітря дорівнює:
а) 22,4 г/моль; б) 29 г/моль;
в) 22,4 дм3/моль; г) 29 дм^Умоль.
6. Молярний об’єм газу (V , дм3), кількість речовини (v, моль) та об’єм цього газу (V, дм3) зв’язані між собою співвідношенням:
а) K= y/v'> б) K1 = v/v; в) ут = у •у; г) V = V + V.
7. Маса (у грамах) карбои(Н) оксиду CO, що займає об’єм 5,6 дм3 (н. у.), дорівнює:
а) 11; 6)7; в) 9; г) 5.
8. Приблизне число молекул кисню в 1 м3 (н. у.) дорівнює:
a) 22,4-1021; б) 81-10"27; в) 2,7-Ю25; г) 6-Ю23.
9. Відомо, що 320 г невідомого газу за нормальних умов займають об’єм 112 дм3. Цим газом є:
a) ClO2; б) SO2; в) CO2; г) NO2.
10. Який об’єм кисню (н. у.) можна отримати розкладанням порції калій перманганату масою 1 г відповідно до рівняння реакції 2KMn01 = K2MnO1 + MnO2 + O2T.
а) 0,1 дм3; б) 0,3 дм3; в) 0,07 дм3; г) 0,03 дм3?
11. Відносна густина показує:
а) у скільки разів один газ густіший за інший;
б) у скільки разів маса одного газу більша за масу іншого газу;
в) у скільки разів один газ важчий за інший;
г) у скільки разів об’єм 1 г одного газу більший за відповідний об’єм іншого газу.
12. Газ із відносною густиною за воднем 17 — це:
а) хлор Cl2;
б) карбон(П) оксид CO;
в) дигідроген сульфід (сірководень) H2S;
г) кисень O2.
13. Назвіть галоген, відносна густина пари якого за повітрям дорівнює 5,52:
а) фтор; б) бром; в) хлор; г) йод.
14. Відомо, що 5 моль двоатомних молекул деякого неметалу мають масу 140 г. Про яку речовину йдеться?
a) O2; б) N2; в) Cl2; г) F2.
15. У якій масі срібла міститься стільки ж атомів, скільки їх
міститься в 19,7 г золота?
а) 6,9; б) 12,3; в) 16,4; г) 10,8.
16. Число молекул у порції азоту N0 об’ємом 8,96 дм3 (н.у.) дорівнює:
а) 2,408-IO23; 6) 6,02- 1023; в) 3,612 • IO23; г) 3,01-IO23.
17. Найпростішою формулою речовини, у якій масові частки Нітрогену та Гідрогену дорівнюють відповідно 75 % і 25 %, є:
a) NH; б) NH2; в) NH3; г) NH1.
18. Найпростішою формулою речовини, у якій масові частки Карбону та Гідрогену дорівнюють відповідно 75 % і 25 %, є:
a) CH1; б) CH3; в) CH2; г) СН.
19. Формулою оксиду Ванадію, у якому маса Ванадію в 1,275 раза більша за масу Оксигеиу, є:
a) VO; б) V2O3; в) VO2; г) V2O5.
20. Формулою оксиду Мангалу, у якому маса Мангану в 1,0181 раза менша від маси Оксигену, є: a) MnO; б) Mn2O3; в) MnO2; г) Mn2Or
Найважливіше в розділі 4
Кількість речовини — фізична величина, яка відображає кількість структурних частинок (атомів, молекул, фор-мульних одиниць тощо) у певній порції речовини.
Одиниця виміру кількості речовини — моль.
1 моль — це така кількість речовини (або її порція), яка містить 6,02 • IO23 частинок (атомів, молекул тощо). Молярною масою називають масу одного моля речовини. Маса речовини, число структурних частинок (атомів, молекул, формульпих одиниць тощо), молярна або формульна маса зв’язані співвідношеннями, на підставі яких можна обчислити будь-яку із цих величин, якщо відомі дві інші:
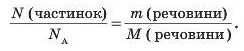
Газувата речовина кількістю 1 моль незалежно від П природи за нормальних умов займає об’єм 22,4 дм3. Цей об’єм називають молярним об’ємом газу.
Молярний об’єм газу — це об’єм 1 моль даного газу.
Закон Авогадро: в однакових об’ємах різних газів за однакових умов (температури та тиску) міститься однакове число молекул.
Відносна густина газу за іншим газом є відношенням молярних або відносних молекулярних мас цих газів.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:08, Переглядів: 12973