§ 34. Кількість речовини. Моль — одиниця кількості речовини
У цьому параграфі ви дізнаєтеся:
• яку порцію речовини називають кількістю речовини;
• що є одиницею виміру цієї фізичної величини.
Ви вже знаєте, що хімічні перетворення речовин можна передати рівняннями реакцій, наприклад:
N2+ O2 = 2N0
Рівняння реакції чітко вказує на те, які порції речовин необхідно взяти для того, щоб вони прореагували без залишку. Це такі порції речовин азоту та кисню, у яких число структурних частинок, а саме число молекул азоту та молекул кисню, було б однаковим.
Проте хіміки, проводячи реакції між речовинами в лабораторії, мають справу не з однією або двома їхніми молекулами чи атомами, а зі зразками речовин, у яких міститься безліч структурних частинок. Зрозуміло, що відлічити «поштучно» потрібне число, наприклад, молекул азоту або молекул кисню, неможливо. Можна зважити порції азоту та кисню, рівні за масою. Але число молекул азоту та молекул кисню в них різне, оскільки маса молекули азоту відрізняється від маси молекули кисню.
Як же визначити, скільки частинок міститься в тій або іншій порції речовини? Які порції речовин азоту та кисню в нашому випадку необхідно взяти, щоб у них містилося потрібне для реакції число частинок? Щоб вирішити цю проблему, порцію речовини, що містить певне число атомів, молекул або інших структурних частинок, прийнято називати кількістю речовини.
Кількість речовини — фізична величина, не менш важлива для характеристики порції речовини, ніж її маса т, об’єм V або
густина р. Кожна фізична величина має одиницю виміру. Для кількості речовини також існує одиниця виміру.
Аби зрозуміти, як учені вибрали одиницю виміру кількості речовини, ознайомимося з однією важливою залежністю. Наприклад, відносна молекулярна маса фтору Mr(F2) = 38. Позначимо число молекул фтору в порції цієї речовини масою 38 г через N. Виявилося, що в порції будь-якої речовини — простої чи складної — масою (у грамах), яка чисельно дорівнює її молекулярній масі (в атомних одиницях маси), міститься така сама кількість N структурних частинок. Так, відносна молекулярна маса кисню Mr (O2) = 16-2 = 32. Отже, у порції кисню масою 32 г міститься стільки ж молекул O2, скільки молекул F2 в порції фтору масою 38 г. Така сама кількість молекул CO2 міститься і в порції карбон(ІУ) оксиду (вуглекислого газу) масою 44 г (відносна молекулярна маса Mr(CO2) = 44).
Такі порції будь-яких речовин називають молями.
Моль — це кількість речовини, яка містить таке число структурних частинок (атомів, молекул тощо), яке дорівнює числу атомів у 12 г ізотопа Карбону 12Ce.
Сьогодні науці відомі абсолютні маси атомів хімічних елементів, і тому експериментально визначено, що в 1 моль речовини міститься 6,02 • IO23 молекул, атомів або інших структурних частинок. Наприклад, стосовно 1 моль азоту N2 це можна підтвердити такими розрахунками:
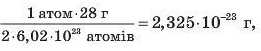
де 2,325510 23 г — абсолютна маса одного атома Нітрогену.
Число 6,02 • IO23 називають числом Авогадро на честь відомого італійського хіміка Амедео Авогадро. Уперше за допомогою складного експерименту вчені визначили значення цього числа наприкінці XIX ст. Число 6,02 • IO23 дуже велике. Аби уявити його, зазначимо лише, що воно більше за число стаканів води, яка міститься у Світовому океані, а щоб зібрати на полях 6,02 • 1023 зерен пшениці, необхідно було б більше 2 мли років. Таким чином, число молекул у порції азоту масою 28 г дорівнює числу Авогадро.
Число структурних частинок, тобто атомів, молекул або інших частинок, в 1 моль будь-якої речовини дорівнює

Величину Nk = 6,02 • IO23 моль 1 називають сталою Авогадро.
Кількість речовини умовно позначають грецькою літерою v (ню). Кількість речовини не характеризує якісь хімічні особливості речовини, а лише вказує на вміст у ній певного числа молекул, атомів або інших структурних частинок. Саме тому кількість речовини належить не до хімічних, а до фізичних величин.
• Приклади розв’язування задач
Розглянемо розв’язування задач за допомогою складання відповідних пропорцій.
Приклад 1. Визначте число молекул, яке міститься в порції хімічної сполуки, кількість речовини якої становить 4 моль.

Приклад 3. Яка маса порції сульфатної кислоти, якщо кількість її речовини становить 0,25 моль?

і Запитання та завдання
1. Яке число молекул міститься в порції хімічної сполуки, кількість речовини якої стаповить З моль?
2. Яку масу матимуть: a) 9,03- 1022 молекул карбоп(ІУ) оксиду (вуглекислого газу) CO2; б) 3,01 • IO21 молекул кисню O2; в) 1,204-IO22 молекул нітроген(ІУ) оксиду NO2.
3. У якій кількості речовини сульфур(УІ) оксиду SO3 міститься: а) 21 моль атомів Оксигену; б) б моль атомів Сульфуру?
* 4. Скільки частинок — атомів і молекул — містить порція
хлору Cl2, кількість речовини якого становить: а) 1 моль;
б) 2 моль; в) 3 моль?
* 5. Які з тверджень, на вашу думку, є правильними:
а) в 1 моль H2O та HF міститься однакова кількість молекул;
б) в 1 моль HF міститься менше молекул, ніж в 1 моль H2O, оскільки маса молекули HF більша за масу молекули H2O.
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:05, Переглядів: 3115