§ 38. Молярний об'єм газів. Закон Авогадро
У цьому параграфі ви:
• дізнаєтеся, що таке молярний об'єм газу;
• навчитеся виконувати обчислення на підставі закону Авогадро.
Відстані між частинками в речовинах, які перебувають у твердому та рідкому станах, незначною мірою відрізняються від розмірів цих частинок. Тому об’єм твердих і рідких речовин практично не залежить від величини зовнішнього тиску. Відстані ж між частинками в речовинах у газуватому стані значно більші, ніж їхні розміри. Порівняємо, наприклад, об’єми, які займає 1 моль азоту N2 у твердому, рідкому та газуватому станах.
Молекула азоту складається з двох атомів Нітрогену. Отже, його відносна молекулярна маса Mr (N2) = 2-14 = 28, а молярна маса M (N2) = 28 г/моль.
За дуже низьких температур (нижчих за -210 °С) азот перетворюється на тверду речовину з густиною 1,03 г/см3. Обчислимо об’єм, який займає 1 моль цієї речовини у твердому стані:
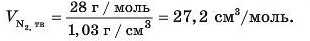
Якщо нагріти твердий азот до температури -210 °С, він розплавиться та перетвориться па рідину, густина якої дорівнює 0,81 г/см3. Визначимо об’єм 1 моль рідкого азоту:
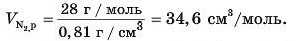
Якщо підвищувати температуру далі, то рідина випаровується й утворюється газ, що заповнює весь об’єм посудини, у якій він міститься.
Яким має бути об'єм посудини з газу вашим азотом, яку помістили в лід за температури 0 °С, щоб у ній утворився тиск в 1 атм?
Густина газу за таких умов 0,00125 г/см3. Тоді об’єм газува-того азоту дорівнює
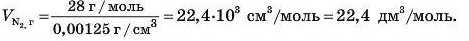
Порівняємо обчислені значення об’ємів 1 моль азоту в різних агрегатних станах. Об’єм азоту в газуватому стані майже в 1000 разів перевищує об’єм тієї самої кількості азоту у твердому стані. Отже, під час переходу речовини в газува-тий стан відстані між її молекулами збільшуються в десятки
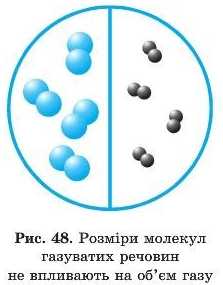
разів. У дослідах з іншими газами отримано такі самі результати, тобто можна стверджувати, що розмір і склад їхніх молекул не впливають на величину об’єму, займаного газом (рис. 48).
Щоб порівнювати об’єми різних газів, заведено вимірювати ці об’єми за однакових умов, а саме: за температури 273 K (0 °С) і тиску 101 325 Па, або 101,3 кПа (760 мм рт. ст., або 1 атм). Такі умови називають ще нормальними умовами та скорочено позначають «и. у.». Таким чином,
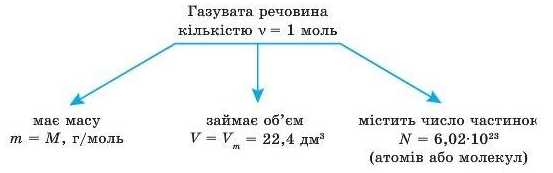
газувата речовина кількістю 1 моль незалежно від її природи за нормальних умов займає об'єм22,4 дм3.
Цей об’єм називають молярним об’ємом газу. Молярний об'єм газу — це об'єм 1 моль даного газу.Його позначають Vm і виражають у дм3/моль (дм3 • моль '). Молярний об’єм Vm газу визначають із відношення об’єму V (X) газу (за н. у.) до відповідної кількості речовини V (X):
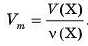
Отже, властивості газуватої речовини, що перебуває за нормальних умов, можна схематично подати так:
Виявлення подібної залежності на початку XIX ст. дало можливість італійському вченому А. Авогадро висунути гіпотезу, яка згодом стала законом Авогадро:
в однакових об’ємах різних газів за однакових умов (температури та тиску) міститься однакове число молекул.
Якщо кількість газуватої речовини v відрізняється від 1 моль, то її можна визначити за формулою
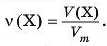
У такому разі для однакової кількості речовини справедливі такі співвідношення:
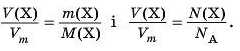
Приклади розв’язування задач На відміну від твердих речовин, гази найчастіше характеризують не масою, а об’ємом.
Приклад 1. Скільки молекул сульфур(ІУ) оксиду міститься в його порції кількістю речовини 1,5 моль? Яка її маса та об’єм за нормальних умов?

Приклад 2. Яка кількість речовини та яке число атомів Нітрогену міститься в порції азоту N2, який займає об’єм 280 дм3 за нормальних умов?


Приклад 3. У 400 г води розчинили 89,6 дм3 HCl за нормальних умов. Яка масова частка (%) хлоридної кислоти в утвореному розчині?

Запитання та завдання
° 1. Що таке молярний об’єм газу? с 2. Які умови називають нормальними? с 3. Сформулюйте закон Лвогадро.
4. Чи однакові числа молекул за нормальних умов: а) в 1 г кисню O2 і в 1 г сульфур(ІУ) оксиду SO.,; б) в 1 дм3 O2 та в 1 дм3802; в) в 1 моль O2 та в 1 моль SO2?
5. Яку масу матимуть гази, об’єми яких виміряно за нормальних умов: а) 4,48 дм3 O2; б) 13,44 AM3SO2; в) 3,36 дм3НС1; г) 5,6 дм3 CH1?
6. Який об’єм за нормальних умов займає: а) хлор Cl2, маса якого становить 28,4 г; б) гідроген йодид НІ, кількість речовини якого дорівнює 0,6 моль; в) кисень O2, маса якого становить 64 кг?
7. Яка відносна молекулярна маса газу, якщо за нормальних умов його об’єм становить 0,32 дм3, а маса — 1,144 г?
8. Якою є молярна маса газу, якщо його густина за нормальних умов дорівнює 1,964 г/дм3?
* 9. Який об’єм за нормальних умов займає суміш 0,5 моль карбон(ГУ) оксиду (вуглекислого газу) CO9 і 0,5 моль кисню O2?
* 10. Який із газів — NH3, HF, NO2 — узяли, якщо його маса
дорівнює 11,5 г і за нормальних умов він займає об’єм 5,6 дм3?
11. У якій масі вуглекислого газу CO2 міститься стільки молекул, скільки їх за нормальних умов міститься у порції метану CH1 об’ємом 6,72 дм3 (за н.у.)?
12. У порції води масою 239 г розчинили 5,6 дм3 (н.у.) карбон(ІІ) оксиду. Якою є масова частка цього газу в розчині?
* 13. У посудину налили 500 г розчину аміаку NH3 з масовою
часткою 25 %. Розчин обережно нагріли, у результаті чого випарилося 3,35 дм3 (н.у.) аміаку та 5 г води. Якою стала масова частка аміаку в утвореному розчині?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:07, Переглядів: 3354