§ 39. Відносна густина газів
У цьому параграфі ви дізнаєтеся про:
• відносну густину газу;
• деякі поняття, користуючись якими ви зможете виконувати різні обчислення для визначення відносної густини газів.
Вивчаючи властивості газу, важливо знати, легший чи важчий він за інші гази або їхні суміші (наприклад, за водень або повітря). Це вкрай необхідно, щоб визначити, де можна застосувати певний газ на практиці, зрозуміти, у яких шарах атмосфери він зосереджується і т. ін. Це важливо знати й для того, щоб вирішити, як розташувати посудину для збирання газу — догори дном (рис. 49) чи догори отвором (рис. 50).
Для того щоб оцінити, легший чи важчий газ порівняно з іншим газом, користуються значенням відносної густини газу.
Із визначення густини р речовини випливає, що маса т порції речовини об’ємом V дорівнює
т (X) = р (X) • V (X).
Згідно із цією формулою однакові об’єми газів за однакових умов (наприклад, за T= 273 KiP= 101 325 Па) мають різні маси через розбіжності у величинах густини P1 і р2 цих газів: "I1(X1) = P1 (X1) • V (X1), т2 (X2) = P2 (X2) • V (X2).

Для 1 моль будь-якого газу за нормальних умов F-=Ffj = = 22,4 дм3/моль, тоді наведена формула для визначення молярної маси газу набуває вигляду
M = 22,4 р.
У хімії заведено густину речовини у твердому або рідкому станах визначати в г/см3, а густину газуватих речовин — у г/дм3. Якщо взяти два гази, наприклад вуглекислий газ CO2 та кисень O.,, кількістю речовини 1 моль, то їхні молярні маси дорівнюватимуть:
M (CO2) = 22,4 • р (CO2);
M (O2) = 22,4 -р (O2).
Обчислимо відношення молярних мас, яке через рівність молярних об’ємів буде таким:
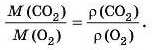
Визначимо молярні маси газів CO9 і O2:
Mr (CO2) = 12 + 2 • 16 = 44,
' M (CO2) = 44 г/моль,
Mr (O2) = 2-16 = 32,
M (O2) = 32 г/моль.
Підставимо одержані значення у відношення:
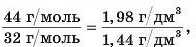
маємо 1,375 = 1,375.
З отриманих результатів видно, що молярна маса CO2 більша за молярну масу O9 в стільки разів, у скільки густина CO2 більша за густину O2 за нормальних умов.
Це відношення значень густини газів у хімії та фізиці називають відносною густиною одного газу за іншим. Відносну густину позначають буквою D:
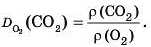
Отже, узагальнюючи результати й умовно позначивши формулу CO2 як X, а формулу O2 — як X1, відносну густину газів можна виразити таким чином:
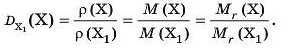
Відносна густина газу за іншим газом є відношенням молярних або відносних молекулярних мас цих газів.
Найчастіше відносну густину газу визначають за воднем і за повітрям.
За молярну масу повітря беруть величину, що дорівнює 29 г/моль, яку ще називають середньою відносною молярною масою повітря. Як відомо, повітря є сумішшю в основному газів азоту та кисню, тому молекули повітря не існує.
Відносну густину будь-якого газу за повітрям і воднем обчислюють відповідно за формулами
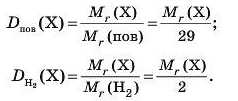
Якщо відома відносна густина газу, наприклад, за воднем або за повітрям, то можна визначити його молярну масу:
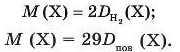
Густину газів можна визначати не тільки за воднем і за повітрям, а й за будь-яким іншим газом.
Як визначити середню відносну молекулярну масу повітря? Спочатку обчислимо відносні молекулярні маси азоту та кисню: Mr (N2) = 2 • 14 = 28; Mr (O2) = 2 • 16 = 32.
Уміст азоту та кисню в повітрі становить близько 78 % і 21 % відповідно. З урахуванням масових часток складових обчислюємо середню відносну молекулярну масу повітря:
Mr (нов) = 28 • 0,78 + 32 • 0,21 = 29, звідси M (пов) = 29 г/моль.
Приклади розв’язування задач IIpinv'лад 1. Якою є густина газуватого хлору (за п. у.)?

Приклад 2. Чому дорівнюють значення відносної густини ди-гідроген сульфіду (сірководню) H2S за воднем H2, повітрям, азотом N2, киснем O2, метаном CH1, карбоп(ІІ) оксидом CO?

Приклад 3. Відносна густина газуватої речовини за метаном CH4 дорівнює 4. Яка відносна молекулярна та молярна маси, а також маса однієї молекули цієї речовини?

— Запитання та завдання
° 1. Що називають відносною густиною одного газу за іншим?
' 2. З якою метою визначають відносну густину повітря?
3. Чому дорівнює густина (г/дм3) сульфур(ІУ) оксиду SO2, якщо 128 г його за нормальних умов займають об’єм 44,8 дм3?
* 4. Як на підставі формули аміаку NH3 визначити його густину за нормальних умов, відносну густину за азотом N2 і за повітрям, а також масу однієї молекули?
5. Відносна густина деякого газу за воднем H2 дорівнює 32. Якою є відносна густина цього газу за повітрям?
6. Чому дорівнює густина газу, якщо 5 дм8його за нормальних умов мають масу 12,05 г, та яка його відносна густина за метаном CH4?
7. Якою є формула газуватої речовини, що складається з атомів Силіцію й Гідрогену та в якій співвідношення цих атомів становить 1 : 4, а відносна густина за повітрям за нормальних умов — 1,103 г/дм3?
8. Відносна густина пари деякої речовини за карбон(ІІ) оксидом CO за нормальних умов дорівнює 6. Якою є відносна молекулярна маса цієї речовини та маса однієї молекули?
4 9. Густина пари фосфору білого за метаном CH1 за деякої температури дорівнює 7,75. Скільки атомів у молекулі фосфору за цих умов?
10. Маса 1 дм3 деякого газу за нормальних умов дорівнює 1,251 г. Якою є відносна густина цього газу за воднем і чому дорівнює маса одного атома, якщо його молекули двохатомні?
11. Маса 300 см3 газу за нормальних умов дорівнює 0,86 г. Яка відносна густина цього газу за азотом N2?
12. Чому дорівнює відносна густина за воднем H2 і за повітрям таких газів, як фтор F2, карбон(ІІ) оксид CO, дигі-дрогеп сульфід H2S?
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 20:08, Переглядів: 5861