Закон Авогадро
Матеріал параграфа допоможе вам:
• з’ясувати суть фізичної величини «молярний об'єм»;
• зрозуміти, чому в однакових об’ємах різних газів міститься однакова кількість молекул;
• розв’язувати задачі з використанням молярного об’єму газу.
Молярний об’єм. Порцію речовини можна характеризувати не тільки за її масою, а й за об’ємом. Тому, крім молярної маси, використовують іншу фізичну величину — молярний об'єм.
Молярним об’ємом називають об’єм 1 моль речовини.
Позначення молярного об’єму — Vm, а одиниці вимірювання — см*/молъ, л/моль.
Із курсу фізики вам відома формула, до якої входять маса речовини (т), її густина (р) і об’єм (V):
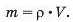
Аналогічний зв’язок існує між молярною масою і молярним об’ємом:

Із цієї формули отримуємо іншу:

За нею можна обчислити молярний об’єм будь-якої речовини. Для цього потрібно розрахувати молярну масу речовини і знайти в довіднику її густину.
Кожна тверда і рідка речовина має своє значення молярного об’єму (наприклад, для алюмінію, кухонної солі, води та етилового спирту — 10, 27, 18 і 58 см^/моль відповідно). Молярний об’єм речовин у твердому і рідкому агрегатних станах, як і їхня густина, майже не залежить від температури і тиску.
Гази при нагріванні або зниженні тиску істотно розширюються, а при охолодженні або підвищенні тиску — стискуються. Це зумовлено тим, що відстані між молекулами в газах дуже вели-
кі (у твердих і рідких речовинах частинки перебувають у контакті одна з одною).

При зміні умов змінюються також густина газу і його молярний об’єм. Тому, наводячи значення цих фізичних величин, обов’язково вказують відповідні температуру і тиск.
Учені встановили, що молярний об’єм різних газів за однакових умов один і той самий. Зокрема, за температури 0 °С і тиску 760 мм рт. ст. (або 101,3 кПа) він становить 22,4 л/моль. Наведені умови називають нормальними (скорочено — н. у.).
1 моль будь-якого газу за нормальних умов займає об’єм 22,4 л.
Описуючи фізичні властивості речовини, указують її агрегатний стан за звичайних умов. У цьому разі йдеться про умови, які найчастіше існують у приміщенні, де вивчають або використовують речовину. Це — температура приблизно +20 0C і тиск приблизно 760 мм рт. ст.
Зв’язок між об’ємом (К), кількістю речовини (η) і молярним об’ємом (Km) описує така формула (спробуйте її вивести самостійно):
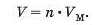
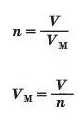
Із неї можна отримати дві інші:
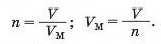
Отже, молярний об'єм — це відношення об’єму до кількості речовини.
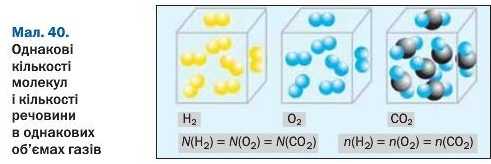
Закон х\вогадро. Ви вже знаєте, що 1 моль водню, кисню чи іншого газу займає за нормальних умов об’єм 22,4 л і містить 6,02 · IO2s молекул. Гіпотезу про однакову кількість молекул в однакових об’ємах різних газів, яка базувалася на результатах досліджень реакцій між газами, висловив на початку XIX ст. А. Авогадро. Отримавши подальше експериментальне підтвердження і теоретичне обґрунтування, ця гіпотеза стала законом.
Закон Авогадро формулюють так:
в однакових об’ємах різних газів за однакових температури і тиску міститься однакова кількість молекул1.
Наводимо важливий наслідок закону Авогадро:
в однакових об’ємах різних газів за однакових температури і тиску містяться однакові кількості речовини.
Викладений матеріал підсумовує малюнок 40.
Розв’язування задач. Розв’яжемо кілька задач із використанням молярного об’єму газу.
ЗАДАЧА 1. Обчислити об'єм 0,4 г водню за нормальних умов.

1 Для інертних газів — однакова кількість атомів.

ЗАДАЧА 2. Обчислити кількість молекул віл кисню за нормальних умов.

Цю задачу можна розв язати ще одним способом. Спочатку обчислюють за відповідними формулами кількість речовини кисню, а потім — кількість молекул.
ЗАДАЧА 3. Розрахувати густину чадного газу CO за нормальних умов.


Молярний об’єм — об'єм 1 моль речовини. Ця фізична величина є відношенням об’єму до кількості речовини.
Молярні об’єми твердих і рідких речовин різні, а газів (за одних і тих самих температури і тиску) — однакові. За нормальних умов (температури 0 °С й тиску 760 мм рт. ст.) 1 моль будь-якого газу займає об’єм 22,4 л.
В однакових об’ємах різних газів за однакових температури і тиску міститься однакова кількість молекул (закон Авогадро).
152. Що таке молярний об’єм речовини? Як можна його розрахувати?
153. Густина азоту17 становить 1,25 г/л. Обчисліть молярний об’єм газу.
154. Густина газу становить 1,43 г/л. Яка молярна маса газу?
155. Знайдіть об'єми газів:
а) водню, взятого кількістю речовини 10 моль;
б) сірководню H2S масою 3,4 г;
в) чадного газу CO масою 0,28 г. (Усно.)
156. Людина за добу видихає разом із повітрям 500 л вуглекислого газу. Визначте масу цього об'єму газу.
157. Обчисліть молярну масу газу, якщо 60 г його займають об’єм 44,8 л. (Усно.)
158. Де міститься найбільше молекул — віл води, 1 л кисню чи 1 л водню? Відповідь поясніть.
159. Маємо однакові маси газів — водню і метану CH4. Яке співвідношення їхніх об'ємів?
для допитливих
Співвідношення об’ємів газів у хімічних реакціях
Згідно із законом Авогадро, однакові об’єми газів містять однако ву кількість молекул (за однакових умов). Якщо кожна молекула одно го газу реагує з однією молекулою іншого, наприклад під час реакції

то повинні взаємодіяти однакові об’єми речовин, скажімо 1 л H2 та 1 л Cl2. У реакції

на один об’єм кисню має припадати два об'єми водню, оскільки тільки за цієї умови кількість молекул водню удвічі перевищуватиме кількість молекул кисню, як того -вимагає* хімічне рівняння.
Узагальненням цих висновків є закон об'ємних співвідношень газів, який відкрив французький учений Ж. Гей-Люссак у 1808 р.:
об'єми газів, що вступають у реакцію та утворюються в результаті реакції, співвідносяться як невеликі цілі числа.
Із часом учені встановили, що ці числа є відповідними коефіцієнтами в хімічних рівняннях.
Отже, для газів у реакціях (1) і (2)
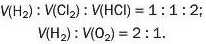
Використання закону Гей-Люссака дає змогу хіміку або інженеру-технологу визначити, які об’єми газів потрібно взяти для здійснення реакції. Відміряти певний об’єм газу значно легше, ніж узяти його певну масу, зваживши на терезах.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:51, Переглядів: 2995