§ 13. Історичні відомості про спроби класифікації хімічних елементів. Поняття про лужні та інертні елементи й галогени
У цьому параграфі ви дізнаєтеся:
• на чому базувалися перші спроби класифікації хімічних елементів;
• які елементи входять до складу природних груп лужних металів, інертних газів та галогенів.
До середини XIX ст. було відкрито вже понад 60 хімічних елементів і досліджено фізичні й хімічні властивості більшості з них. Деякі з відкритих елементів ще не вдалося на той час виділити в чистому вигляді.
Відкриття нових елементів, дослідження їхніх властивостей, а також властивостей їхніх сполук, з одного боку, дали можливість накопичити досить значний фактичний матеріал, а з другого — виявили необхідність його систематизації.
Іншими словами, потрібно було знайти взаємозв’язок між хімічними елементами та їхніми сполуками як з точки зору якісного, так і кількісного складу.
Першу спробу систематизації або, як її тепер називають, класифікації елементів зробив А. Лавуазье. Пізніше Й. Я. Берце-ліус узяв за основу їхні загальні групові властивості. Так, було виявлено, що найчіткіше основний характер виражений у сполуках, утворених лужними металічними елементами, а спроможність до виявлення кислотних властивостей — у сполуках хімічних елементів, названих галогенами. Таким чином виник розподіл елементів на металічні і неметалічні, який базувався на основі їхніх якісних характеристик — хімічних і фізичних властивостей.
Серед металічних елементів Калій, наприклад, за своїми властивостями подібний до Натрію. Прості речовини, які утворені
цими елементами, — метали. Вони мають металевий блиск, дуже м’які (їх можна різати навіть ножем), пластичні, тобто легко деформуються.
Ці метали добре проводять електричний струм і теплоту, легко плавляться. Порівняно з іншими металами вони відрізняються високою хімічною активністю. Так, якщо розрізати шматок натрію, то на зрізі ми побачимо яскравий металевий блиск. Але миттєво поверхня металу тьмяніє: утворюються продукти реакції окиснення в результаті взаємодії натрію з киснем повітря. Через це натрій зберігають під шаром гасу. Ці метали енергійно реагують і з іншими неметалами — хлором, сіркою, а також з водою та кислотами (часто з вибухом).
Сполуки Калію та Натрію також належать до одного класу, мають аналогічний склад і подібні властивості. Елементи Калій і Натрій у сполуках виявляють валентність І. їхні оксиди K2O і Na2O виявляють сильні основні властивості. Під час взаємодії з водою вони утворюють луги — калій гідроксид КОИ і натрій гідроксид NaOH. Літій Li, Рубідій Rb і Цезій Cs за своїми властивостями подібні до Натрію та Калію. Усі ці метали назвали лужними (згодом до цієї групи включили Францій Fr).
Серед неметалічних також є групи елементів, подібних за властивостями: Хлор СІ, Бром Br, Йод І (дещо пізніше до цієї групи включили Флуор F). Прості речовини, утворені цими елементами, є типовими неметалами. За звичайних умов фтор F2 і хлор Cl2 перебувають у газуватому стані, бром Br2 — у рідкому, йод I2 — у вигляді кристалічної речовини, що легко переходить у газуватий стан. Вони взаємодіють із металами з утворенням солей. Наприклад, хлор унаслідок взаємодії з металами утворює солі хлоридиої кислоти HCl — хлориди:
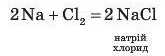
У реакціях фтору з металами утворюються солі фторидної (плавикової) кислоти HF:
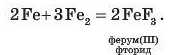
Подібно до хлору й фтору реагують бром і йод з утворенням солей: NaBr, NaI, MgBr2, MgI2 тощо.
Ці елементи та утворені ними прості речовини називають галогенами (у перекладі з грецької «ті, що народжують солі»). Молекули галогенів складаються з двох атомів. Галогенам притаманна найбільша хімічна активність серед неметалів. Вони
легко взаємодіють як із металами, так і з лугами, але не реагують із кислотами. Винятком із цього правила є йод, який спроможний окиснюватися нітратною кислотою.
У сполуках з металічними елементами галогени виявляють валентність І, а в сполуках з Оксигеиом (їх отримують посереднім шляхом) — змінну валентність від І до VII. Оксид, у якому хімічний елемент виявляє найвищу валентність, називають вищим. Наприклад, вищий оксид Хлору має склад Cl2O7.
Сполуки галогенів з Гідрогеном також подібні за складом (HF, НС1, HBr, НІ, атом галогену в них виявляє валентність І) і властивостями: їхні водні розчини є кислотами.
До групи інертних, або благородних, газів належать шість иеметалічних елементів: Гелій Не, Неон Ne, Аргон Аг, Криптон Kr, Ксенон Xe і Радон Rn. Відповідні прості речовини, на відміну від галогенів, складаються з одноатомних молекул. За кімнатної температури вони безбарвні, малорозчинні у воді. Ці гази в невеликій кількості наявні в повітрі.
Довгий час уважали, що інертні гази зовсім не вступають у хімічні реакції. Про це свідчить і їхня загальна назва, яка походить від латинського слова inertia, що означає «бездіяльність». Однак за останні 40 років ученим удалося отримати сполуки трьох важких газів — Криптону, Ксенону й Радону з іншими елементами. Слід зазначити, що всі ці сполуки нестійкі й не витримують сильного нагрівання.
Як бачимо, і самі елементи, і їхні сполуки, і прості речовини (лужні метали й галогени, а також інертні гази) різко відрізняються за своїми властивостями. Щоби пояснити причини відмінностей у властивостях різних елементів та їхніх сполук, учені почали пов’язувати якісні характеристики з кількісними. Насамперед розглядали відносну атомну масу елементів та їхню валентність, яка характеризує спроможність елемента утворювати різні за складом сполуки.
• Для допитливих
Із хімічною інертністю благородних газів пов’язано їхнє застосування у техніці. Аргоном наповнюють електричні лампи розжарювання. У центрі скляного балона розміщена спіраль з вольфраму, яка розжарюється до високих температур під час проходження по ній електричного струму й випромінює світло. Якщо до балона потрапить повітря, вольфрам миттєво вступить у реакцію з киснем і спіраль згорить. Аби запобігти цьому, лампу наповнюють інертним газом аргоном, який не реагує з вольфрамом ні за яких умов.
Учені виявили, що під час пропускання електричного струму через розріджений інертний газ спостерігається яскраве світіння. Це явище використано в люмінесцентних лампах. Лампи, наповнені аргоном, дають яскраво-синє світло, наповнені неоном — помаранчево-червоне, криптоном — зелене. Потужними неоновими лампами обладнані маяки. Найлегшим з інертних газів — гелієм — заповнюють метеорологічні кулі-зонди, дирижаблі, аеростати.
• Запитання та завдання
°1. З наведеного переліку хімічних елементів випишіть окремо ті, що відповідають: а) лужним металічним елементам; б) галогенам; в) інертним газам.
Н, Cl, Rb, Na, Br, Al, Xe, Cl, Li,
Ne, Ba, К, Be, Sr, F, Fe, Не, Аг.
°2. Складіть рівняння реакцій галогенів: а) з барієм; б) цинком; в) алюмінієм; г) силіцієм. Дайте назви утвореним сполукам.
°3. Кальцій Ca, Стронцій Sr і Барій Ba мають властивості, подібні до властивостей лужних металічних елементів, однак у сполуках виявляють валентність II. їх називають лужноземельними металами, оскільки їхні оксиди раніше називали землями. Який склад та які хімічні властивості їхніх оксидів і гідроксидів?
4. Який взаємозв’язок між хімічними елементами та їхніми сполуками намагалися знайти вчені для систематизації елементів?
5. Які характеристики елементів учені почали пов’язувати між собою, щоби пояснити причини відмінностей у властивостях різних елементів та їхніх сполук?
6. Назвіть відомі вам групи, або родини, хімічних елементів і охарактеризуйте одне з них.
*7. Напишіть рівняння таких реакцій: 2
Це матеріал з підручника Хімія 8 клас Бутенко
Автор: admin от 19-10-2016, 19:44, Переглядів: 1431