§ 4. Короткі історичні відомості про спроби класифікації хімічних елементів. Поняття про лужні, інертні елементи, галогени

Опрацювавши параграф, ви дізнаєтеся:
як учені намагалися класифікувати хімічні елементи; про існування природних груп хімічних елементів.
Кожна наука починається з нагромадження фактів. Чим більше накопичується фактів, тим необхіднішою стає їх класифікація.
Вчені різних країн намагалися об’єднати хімічні елементи у групи за найбільш очевидними спільними ознаками та властивостями простих і складних речовин, які ВОНИ З'творюють.
1. Класифікація хімічних елементів И.Я. Берцеліусом
Перша ісласифішщія відомих на тон час хімічних елементів, здійснена шведським хі-міком И.Я. Берцеліусом у 1812 р., полягала в поділі їх за властивостями утворених сполук із Оксигеном на метали (тобто металічні елементи) і металоїди (тобто неметалічні елементи). Проте ця класифікація була недосконалою, оскільки не пояснювала властивостей сполук перехідних елементів (мова про перехідні елементи йтиме у підручнику згодом). Наведіть по два-три приклади відомих вам металічних і неметалічних елементів.
2. Класифікація хімічних елементів И. Деберейнером
У 1817 р. німецький хімік Иоганн Де-берейнер зауважив, що якщо розташува-
ти три схожих за хімічними властивостями елементи в порядку зростання їх відносних атомних мас, то відносна атомна маса другого (середнього) елемента дорівнює середньому арифметичному відносних атомних мас першого і третього елементів. Спочатку Деберейнер встановив таку закономірність для першої «тріади» елементів — Кальцію, Стронцію та Барію. Згодом учений запропонував ще дві тріади (Літій, Натрій, Калій і Сульфур, Селен, Телур). В основу своєї класифікації, крім відносних атомних мас, він поклав також подібність властивостей елементів і їхніх сполук.
Попри те, що характер класифікації елементів за властивостями набагато складніший, ніж поділ на тріади, закон тріад Дебе-рейнера підготував ґрунт для систематизації елементів, що завершилася створенням періодичного закону.
Зробіть необхідні обчислення і переконайтеся, що відносна атомна маса Натрію є середнім арифметичним відносних атомних мас Літію і Калію.
Зробіть подібні розрахунки для інших двох «тріад» Деберейнера.
3. Класифікація хімічних елементів Д. Ньюлендсом
У 1864 році Джон Ньюлендс уперше розташував відомі на той час хімічні елементи за збільшенням їхніх відносних атомних мас:
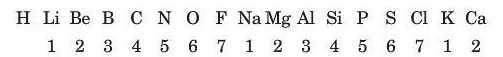

Він зазначив, що у цьому ряду спостерігається періодична поява хімічно подібних елементів. Пронумерувавши елементи в цьому ряду (елементи, які мали однакові властивості, мали й однаковий номер) і порівнявши номери з властивостями елементів, він зробив висновок, що кожен восьмий елемент є подібним за властивостями до першого елемента, наприклад: Літій подібний до Натрію і Калію, Карбон до Силіцію тощо. Так салю, як у музиці восьма нота в октаві є подібною до першої. Своє відкриття вчений назвав «законолі октав»: номери подібних елеліентів відрізняються на сім або
на число, яке кратне семи. Таким чином, Ньюлендс уперше висунув припущення про періодичність змін властивостей елементів.
4. Класифікація хімічних елементів Л.Ю. Меєром

У 1864 році свою першу таблицю опублікував німецький хімік Лотар Меєр. Таблиця складалася із 28 хімічних елементів, згрупованих за валентністю. Меєр навмисно обмежив число елементів у таблиці, щоб підкреслити закономірну зміну відносних атомних мас подібних елементів.
Робота Меєра не мала систематичного характеру, а відтак — характеру закону.
5. Лужні елементи
У міру зростання кількості відомих хімічних елементів учені намагалися виділити з їхнього числа природні родини з подібними властивостями.
Калій, наприклад, за багатьма властивостям нагадує Натрій. Обидві прості речовини, утворені цими елементами, — калій і натрій — легкоплавкі сріблясто-білі метали, такі м’які, що їх можна різати ножем. Вони мають високу хімічну активність — взаємодіють із киснем повітря та іншими неметалами — хлором, сіркою, а також з водою. У сполуках Калій і Натрій одновалентні. їхні оксиди при взаємодії з водою утворюють луги — натрій гідроксид і калій гідроксид.
Літій, рубідій, цезій і францій за своїми властивостями схожі на натрій і калій. Усі ці метали називають лужними, а відповідні їм хімічні елементи (Літій Li, Натрій Na, Калій К, Рубідій Rb, Цезій Cs, Францій Fr) — лужними елементами, тому що їм відповідають луги складу MeOH, де Me — будь-який із лужних елементів. Знайдіть у періодичній системі лужні елементи.
6. Галогени
Серед неметалічних елементів також є групи подібних за
SJ
властивостями елементів: Флуор F, Хлор СІ, Бром Br і Иод І, які об’єднані у групу галогенів.
Знайдіть у періодичній системі галогени.
Молекули простих речовин-галогенів двохатомні: фтор F9, хлор Cl2, бром Br2, йод I2.
Галогени — найбільш активні неметали. Унаслідок реакцій між галогенами і воднем утворюються сполуки: HF, НС1, HBr, НІ, які добре розчиняються у воді; розчини цих сполук є кислотами.
Галогени реагують і з металами. У сполуках з металічними елементами, як і з Гідрогеном, галогени одновалентні.
7. Інертні елементи
Ще одну родину утворюють Гелій Не, Неон Ne, Аргон Аг, Криптон Kr, Ксенон Xe і Радон Rn. Ix називають інертними елементами. Знайдіть у періодичній системі інертні елементи.
Прості речовини, утворені інертними елементами, складаються з одноатомних молекул. Усі вони за звичайних умов є газами, які в невеликих кількостях містяться в повітрі. Донедавна вчені вважали, що інертні елементи взагалі не утворюють хімічних сполук, про що свідчить їхня назва. Однак за останні кілька десятків років вдалося здобути нестійкі сполуки Криптону, Ксенону й Радону.
Якщо хочете знати хімію глибше...
Існують ще й інші природні групи хімічних елементів: лужноземельні (Магній Mg, Кальцій Ca, Стронцій Sr, Барій Ba, Радій Ra), халькогени (Оксиген О, Сульфур S, Селен Se, Телур Те), пнік-тогени (Нітроген N, Фосфор Р, Арсен As).
.. .Гелій спочатку був відкритий на Сонці, а потім — на Землі. ..назва Літію походить від грецького «камінь»; назва Калію — від арабського «поташ», назва Натрію означає «речовина, іцо бурлить»; назви Цезій (з латинської «блакитний») і Рубідій (з латинської «темно-червоний») пов'язані з синіми і червоними лініями спектра, за якими вони були відкриті. Радіоактивний елемент Францій був передбачений Д.1. Менделєєвим, після відкриття названий на честь Франції.
...назва «галогени» у перекладі з грецької означає «ті, що народжують солі».
...назва «Хлор» походить від грецького «жовто-зелений» (ко-лір газоподібного хлору); Иод — від грецького «фіалковий» (за колір газоподібного йоду); Бром — від грецького «смердючий» (за різкий неприємний запах рідкого і газоподібного брому). Назва Флуору походить від латинського «плинний», оскільки добавки мінералу, що містить Флуор, до металічних руд полегшують їх плавлення.
. ..коли У. Рамзай уперше випаровував рідкий аргон, перші порції газу він зібрае окреме. Ці газові бульбашки вчений піддає спектральному аналізу і не помилився у своїх сподіваннях. Трубка світилася ясно-червоним сяйвом. Назву новому газу дав дванадцятирічний син Рамзая. Ось як розповідає про це сам учений: «Коли ми вперше розглядали спектр, при цьому був і мій син Віллі.
— Тату, — сказав він, — як називається цей красивий газ ?
— Це ще не вирішено, — відповів я.
— Що він, новий ? — поцікавився син.
— Нововідкритий, — заперечив я.
— То чому б не назвати його посип — латинське «новий»?
— Це не підходить, бо посип не грецьке слово. Ми назвемо його «неоном», бо по-грецьки «неос» означає «новий».
... сполуки Натрію забарвлюють полум’я у жовтий колір, а Калію—у фіалковий.
і ВИСНОВКИ ^і
Перші спроби класифікації хімічних елементів не були науково обґрунтованими.
снують природні групи хімічних елементів, які мають схожі властивості.
Початковий рівень
1. Які природні групи хімічних елементів ви знаєте?
2. Укажіть порядковий номер лужного елемента.
А) 10 Б) 11 В) 12 Г) 13
3. Укажіть символ галогену.
A) C Б) Cl В) Cu Г) Ca
4. Укажіть назву інертного елемента.
А) Гідроген В) Аргон
Б) Оксиген Г) Сульфур
Середній рівень
5. Як учені намагалися класифікувати хімічні елементи?
6. Чи співпадає наведена у параграфі послідовність елементів ряд}' Ньюлендса з їх послідовністю у сучасній періодичній системі? Знайдіть у літературних джерелах чи в мережі Інтернет решту «октав» Ньюлендса, запишіть їх у зошиті і знову порівняйте з розташуванням цих елементів у періодичній системі.
7. Складіть розповідь про використання інертних газів.
Достатній рівень
8. Із поданого переліку хімічних елементів випишіть окремо: а) лужні елементи; б) галогени; в) інертні елементи.
Br, Na, Al, Ca, S, Хе, К, Cl, I, Li, Ba, Ne, Be, Rb, Sr, F, Fe, Не, Н.
9. Складіть формули продуктів реакції за валентністю елементів. Схеми реакцій перетворіть на хімічні рівняння:
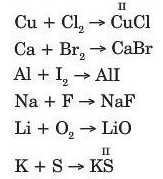
До якого типу належать ці реакції?
Високий рівень
10. Обчисліть масову частку металічного елемента у натрій гідроксиді.
11. Напишіть формули лугів, утворених Літієм, Калієм і Рубідієм. Не виконуючи обчислень, укажіть, у якій речовині масова частка Оксигену найбільша. Відповідь поясніть.
12. * Напишіть рівняння реакцій галогенів з воднем.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 08:06, Переглядів: 3258