Перші спроби класифікації хімічних елементів
Матеріал параграфа допоможе вам:
• з'ясувати, як розвивалися уявлення про хімічний елемент;
• дізнатися про перші спроби класифікації хімічних елементів.
Розвиток уявлень про хімічний елемент. Давньогрецькі філософи вважали, що всі речовини складаються із чотирьох елементів-першона-чал: вогню, повітря, води і землі. На їхню думку, ці «стихії» є носіями певних якостей, притаманних речовинам, — теплоти, холоду, вологості й сухості. Таких поглядів дотримувалися й алхіміки.
Термін «елемент», який за змістом наближається до сучасного, з’явився в науці у XVII ст. Англійський хімік Р. Бойль назвав елементом те, що є межею розкладу речовини. Якби ми жили тоді, то сказали б, що елемент — це атом. Такий смисл вкладав у слово «елемент» і М. В. Ломоносов.
Французький учений А.-Л. Лавуазье вважав елементом просту речовину, бо її не можна розкласти на інші речовини. Однак нині відомо, що не розкладається й чимало складних речовин, наприклад оксиди SiO2* Al2O3, а проста речовина озон легко перетворюється на іншу просту — кисень: 203 = 302. Не розрізняв елемента і простої речовини також англійський учений Дж. Дальтон. Пізніше Д. І. Менделєєв висловив таку думку: «Просте тіло є речовиною... а під елементом слід розуміти складники простих і складних тіл».
На початку XX ст. учені встановили, що атом складається з позитивно зарядженого ядра і негативно заряджених електронів. Відтоді почали визначати хімічний елемент як вид атомів із певним зарядом ядра. Нині, характеризуючи якісний склад води, кожен із вас сказке, що ця речовина утворена молекулами, які містять атоми двох видів (із зарядами ядер + Ii +8). Інакше кажучи, вода є сполукою двох елементів — Гідрогену та Оксигену.
Перші спроби класифікації хімічних елементів. У часи становлення науки хімії вчені намагалися «навести порядок» серед кількох десятків відомих тоді хімічних елементів, здійснити їх класифікацію.
Класифікація — це поділ об’єктів (предметів, живих організмів, явищ тощо) на групи або класи за певними ознаками.
У хімії існують класифікації елементів, речовин, хімічних реакцій.
► На які групи поділяють речовини? Назвіть
відомі вам типи хімічних реакцій.
Класифікацію простих речовин, на основі якої пізніше виникла перша класифікація хімічних елементів, запропонував наприкінці XVlH ст. А.-Л. Лавуазье. Він поділив прості речовини на метали і неметали (нині хімічні елементи, як вам відомо, поділяють на металічні та неметалічні). Така класифікація була надто загальною й недосконалою. Деякі прості речовини (наприклад, графіт, телур) за одними властивостями нагадували метали, а за іншими — неметали. Однак поділ простих речовин, а також хімічних елементів на дві великі групи відіграв важливу роль у розвитку хімії.
Серед металів і серед неметалів траплялися дуже схожі речовини. їх учені об'єднали в окремі групи, які отримали такі загальні назви: лужні метали, лужноземельні метали, галогени, інертні гази.
Лужні метали. Це — літій, натрій, калій, рубідій, цезій, францій. Вони легкі, м’які (мал. 1), легкоплавкі, у хімічних реакціях виявляють дуже високу активність (мал. 2). Перебуваючи за звичайних умов на повітрі, лужні метали швидко взаємодіють із киснем, водяною парою. Тому їх зберігають у гасі в герметично закритих посудинах (мал. 3) або в ампулах, з яких видалено повітря. Указані метали назвали лужними, оскільки вони реагують з водою з утворенням лугів — розчинних основ із загальною формулою MOH.

Лужноземельні метали. До цих речовин належать магній, кальцій, стронцій, барій, радій. Вони нагадують лужні метали, реагують із багатьма речовинами, але не так активно. Продуктами їх реакцій з водою е луги1 із загальною формулою M(OH)2.
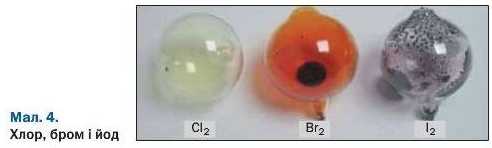
Галогени. Так називають найактивніші неметали — фтор, хлор, бром, йод. Ці прості речовини складаються із двохатомних молекул: F2, Cl2, Br2, I2. За звичайних умов фтор і хлор — гази, бром — рідина, а йод — тверда речовина (мал. 4). Найактивнішим серед галогенів та інших неметалів є фтор.
Галогени реагують із воднем з утворенням сполук, що мають формули HF, HCl, HBr, НІ. Ці сполуки за звичайних умов є газами, добре розчиняються у воді. Галогени взаємодіють і з багатьма металами. Продукти таких реакцій — солі. Тому назва «галогени» походить від грецького слова halos — сіль (вам відома сполука Натрію з Хлором — NaCl, кухонна сіль).
1 Магній гідроксид до лугів не відносять.
Інертні гази. Ці прості речовини було відкрито у другій половині XIX ст. Вони отримали таку назву, оскільки не вступали в хімічні реакції. До інертних газів належать гелій, неон, аргон, криптон, ксенон, радон. Вони складаються не з молекул, як інші гази, а з атомів.
Цікаво знати
Інертний газ гелій учені спочатку виявили на Сонці і тільки через
13 років — на нашій планеті.
Елементи, від яких походять розглянуті прості речовини, мають аналогічні загальні назви: лужні елементи, лужноземельні елементи, галогени, інертні елементи.
Наприкінці 20-х років XIX ст. німецький учений В. Деберейнер розподілив частину подібних елементів на трійки, або тріади:
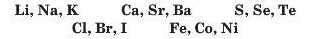
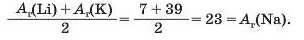
У першій тріаді опинилися лужні елементи, у другій — лужноземельні, у четвертій — галогени. Розмістивши елементи у тріадах за збільшенням відносних атомних мас, Деберейнер виявив цікаву закономірність: напівсума відносних атомних мас двох крайніх у тріаді елементів приблизно чи точно дорівнювача відносній атомній масі «центрачьного» елемента. Покажемо це для першої тріади:
Крім того, властивості простої речовини та сполук цього елемента виявилися «проміжними» "'шІАМ.чїнгііао'іЧеишегйтжи^ лігводтагаг•нн’таич.л,.
Таблиця І
Таблиця хімічних елементів Л. Мейєра
|
Значення валентності |
|||||
|
IV |
III |
II |
І |
1 |
II |
 |
 |
 |
 |
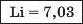 |
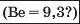 |
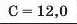 |
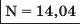 |
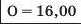 |
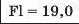 |
 |
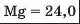 |
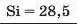 |
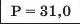 |
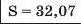 |
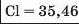 |
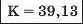 |
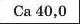 |
 |
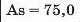 |
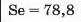 |
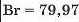 |
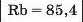 |
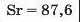 |
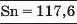 |
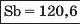 |
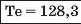 |
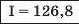 |
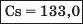 |
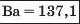 |
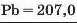 |
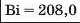 |
 |
 |
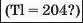 |
 |
Розглянуті спроби вчених об’єднати хімічні елементи створили передумови для відкриття Д. І. Менделєєвим періодичного закону.
У явлення про хімічний елемент із розвитком науки змінювалися. Раніше хіміки не розрізняли хімічного елемента і простої речовини. Було відомо кілька груп подібних простих речовин; серед них — лужні метали, галогени. Пізніше вчені відкрили інертні гази.
Перші спроби класифікації хімічних елементів охоплювали лише їх частину і не мали достатнього обґрунтування.
1. Що раніше вважали хімічним елементом і як визначають його нині?
2. Виберіть ознаки, які були використані А.-Л. Лавуазье, В. Деберейне-ром, Дж. Ньюлендсом, Л. Мейером для класифікації простих речовин та хімічних елементів: властивості простих речовин, поширеність елементів у природі, склад характерних сполук, значення відносних атомних мас, значення валентності елементів.
3. Охарактеризуйте розміщення елементів кожної тріади Деберейнера в періодичній системі.
4. Зіставте відносну атомну масу Брому з напівсумою відносних атомних мас Хлору і Йоду.
5. Порівняйте ряд елементів Дж. Ньюлендса з їх послідовністю в періодичній системі Д. І. Менделєєва і знайдіть відмінності.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:38, Переглядів: 7859