§ 5. Поняття про лужні елементи, галогени та інертні елементи
Пригадайте, як взаємодіють різні оксиди з водою (за § 2); чому лужні елементи отримали таку назву (за § 4).
Лужні елементи
Лужні елементи — це найактивніші металічні елементи, вони розташовані в І групі Періодичної системи.

Лужні елементи:
• найактивніші металічні елементи
• виявляють сталу валентність І
• здатні утворювати луги
Загальні формули
сполук:
• оксидів — R0O
• гідроксидів (лугів) — ROII
Лужні метали:
• легкі, м’які
• надзвичайно хімічно активні
Прості речовини метали, утворені цими елементами, також називають лужними. Вони значно легші за інші метали (залізо, мідь, алюміній), дуже м’які і можуть різатися ножем (мал. 5.In).
Лужні метали мають найяскравіше виявлені металічні властивості: вони вступають у реакції з киснем, водою й кислотами, їх взаємодія з водою відбувається дуже активно, іноді з вибухом (мал. 5.16).

Гідроксиди лужних елементів — розчинні основи (луги) із загальною формулою ROH, де R будь-який з лужних елементів, наприклад:
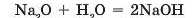
Гідроксиди Рубідію й Цезію такі активні, що їх концентровані розчини легко руйнують скло навіть за звичайної температури, а розплави — залізо й навіть платину.
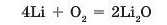
Лужні елементи утворюють оксиди із загальною формулою R.,О, наприклад:
Лужні метали настільки активні, що трапляються в природі виключно у вигляді сполук. Добути їх можна тільки дією електричного струму на їхні сполуки. Натрій і калій уперше були добуті Майклом Фарадеєм саме в такий спосіб.
Галогени
Галогени — це найактивніші неметалічні елементи, вони розташовані в VH групі Періодичної системи.
Елементи-галогени:
• найактивніші неметалічні елементи
• виявляють змінну валентність, але всі можуть виявляти валентність І
Загальні формули
сполук:
• оксидів — R0O7 (крім Флуору)
• летких сполук
з Гідрогеном — IIR
Прості речовини
галогени:
• утворені двохатомними молекулами
• надзвичайно хімічно активні
Флуор F, Хлор СІ, Бром Br, Йод І, Астат At, Унунсептій Uus
Як у випадку з лужними елементами, для галогенів також характерні спільні властивості, зокрема, у сполуках усі вони здатні виявляти валентність І.
Прості речовини, утворені цими елементами, також називають галогенами. За звичайних умов галогени перебувають у різних агрегатних станах: хлор та фтор газуваті, бром — рідина, а йод — твердий, але всі вони мають характерні запах і забарвлення (мал. 5.2, с. 26). Галогени є речовинами молекулярної будови, молекули яких складаються з двох атомів: F2, Cl.,, Br2, I2.
Мал. 5.2. Галогени за звичайних умов перебувають у різних агрегатних станах: а — хлор — жовто-зелений газ; б — бром — летка рідина темно-жовтого кольору; в — йод — летка кристалічна речовина чорно-фіолетового кольору з металічним блиском

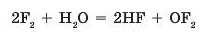
Галогени — це найактивніші неметали. Вони легко вступають у реакції з багатьма речовинами. А в атмосфері фтору навіть вода здатна горіти:
З воднем галогени також взаємодіють дуже активно, іноді з вибухом. Результатом реакції є леткі сполуки з Гідрогеном загального складу HR, водні розчини яких є кислотами:
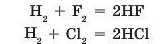
Галогени активно реагують з металами. Продуктами таких реакцій є солі — галогеніди (флуориди, хлориди, броміди, йодиди):
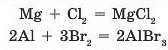
--- ---2 ------3
Саме завдяки властивості утворювати солі ці елементи і назвали галогенами (від грец. галос — сіль).
Інертні елементи
Ще одну родину утворюють елементи VHI групи Періодичної системи. їх називають інертними елементами.
Інертні елементи:
• хімічно неактивні
• у простих речовинах існують у вигляді окремих атомів
Гелій Не, Неон Ne, Аргон Аг, Криптон Kr, Ксенон Хе, Радон Rn, Унуноктій Uuo
Прості речовини, утворені ними, називають інертними гсмими або іноді ще благородними, вони складаються з одноатомних молекул. Усі вони за звичайних умов є газа-
ми, що в незначних кількостях містяться в повітрі.

Донедавна вважалося, що інертні гази взагалі не утворюють хімічних сполук (про що говорить їхня назва).
Однак за останні декілька десятиліть ученим вдалося добути багато сполук Криптону, Ксенону і Радону з Оксиге-ном та Флуором.
Найлегший з інертних елементів —
Гелій — був першим хімічним елементом, виявленим поза Землею (мал 5.3). Аналізуючи випромінювання Сонця за допомогою спектрального аналізу, П’єр Жансан у 1868 р. виявив світіння, не характерне для жодного з відомих на той час елементів. Саме тому цей елемент був названий Гелієм (від грец. Helios — сонце). Певна річ, складно відкрити елементи, які не утворюють сполук, але після відкриття Гелію вчені почали ретельніше вивчати гази і незабаром відкрили всі інертні елементи.
Висновки
1. Найхарактерніші родини хімічних елементів — це лужні елементи, галогени та інертні елементи. Кожна родина характеризується спільними властивостями як елементів, так і утворених ними сполук.
2. Лужні рпрмрнти — актиині мртяпічні рпрмрнти, у сполуках виявляють валентність І. Прості речовини, утворені ними,— лужні метали — активно взаємодіють з водою, галогенами та іншими речовинами.
3. Галогени — активні неметалічні елементи. Усі галогени здатні виявляти валентність І. Прості речовини галогенів утворені двохатомними молекулами, вони виявляють високу хімічну активність, взаємодіють з багатьма речовинами.
4. Інертні елементи хімічно майже неактивні, вони не утворюють сполук з іншими елементами, у невеликих кількостях містяться в повітрі.
Контрольні запитання
1. Назвіть спільні властивості лужних елементів, галогенів та інертних елементів, завдяки яким їх виокремлюють у родини.
2. Перелічіть хімічні елементи-галогени, випишіть їхні символи у стовпчик, укажіть, металічні ці елементи чи неметалічні.
3. Уміст Рубідію в земній корі майже такий самий, як і Купруму. Але на відміну від останнього Рубідій не утворює власних мінералів і, тим більше, руд. Запропонуйте пояснення цьому факту.
4. Елементи восьмої групи Періодичної системи називають: а) інертними;
6) галогенами; в) лужними.
Завдання для засвоєння матеріалу
1. Уявіть, що перед вами однакові за формою і розміром зразки літію і заліза. Як відрізнити ці речовини, ґрунтуючись тільки на відмінностях їхніх фізичних властивостей?
2. Складіть рівняння реакції взаємодії будь-якого з галогенів: а) з калієм;
б) кальцієм; в) алюмінієм; г) воднем.
3. Силіцій взаємодіє з хлором з утворенням вищого хлориду. Складіть формулу сполуки Силіцію з Хлором, якщо останній виявляє в цій сполуці валентність І.
4. Калій при слабкому нагріванні бурхливо взаємодіє із сіркою, а розплавлений калій згоряє в атмосфері хлору. Складіть рівняння цих реакцій.
5. У якому з оксидів лужних елементів масова частка Оксигену найбільша?
6*. Знайдіть у додатковій літературі інформацію про відкриття інертних газів. Як ви вважаєте, чим можна пояснити той факт, що всі благородні гази були відкриті майже одночасно: у період 1894-1900 рр.
Лінгвістично задача
У перекладі з грецькоїхлорос означає зелений, бромос — смердючий, йодес — фіолетовий. Як ви вважаєте, з якими властивостями хлору, брому та йоду пов'язані їхні назви?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:45, Переглядів: 8694