§ 7. Періодична система хімічних елементів
Короткий і довгий варіанти графічного представлення Періодичної системи
Ґрунтуючись на Періодичному законі, Д. І. Менделєєв створив класифікацію хімічних елементів, яку називають Періодичною системою. Зазвичай її представляють у вигляді таблиці.
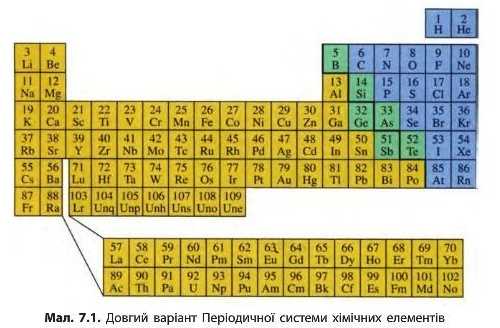
Сьогодні частіше використовують два варіанти графічного представлення Періодичної системи: короткий та довгий. Д. І. Менделєєв частіше використовував компактніший короткий варіант Періодичної системи (див. перший форзац підручника). У ній великі періоди розбиті на два рядки, у кожному з яких вища валентність елементів послідовно зростає від І до VIII.
Якщо ж записати символи елементів кожного періоду в окремий рядок так, щоб кожна природна родина (лужні елементи, галогени, інертні елементи) утворювала окремий вертикальний стовпчик, то отримаємо довгий варіант Періодичної системи (мал. 7. і). Цей : £ варіант був запропонований Альфредом Вернером значно пізніше після відкриття Періодичного закону.
Групи елементів. Головні й побічні підгрупи
Вертикальні стовпчики Періодичної системи називають групами. У короткому варіанті таблиці номери груп позначають римськими цифрами, а число груп дорівнює восьми. Номер групи зазвичай збігається з вищою валентністю хімічного елемента.
Кожну групу розділяють на дві підгрупи — головну й побічну. До головної підгрупи належать елементи як малих, так і великих періодів, а до побічної — лише великих.
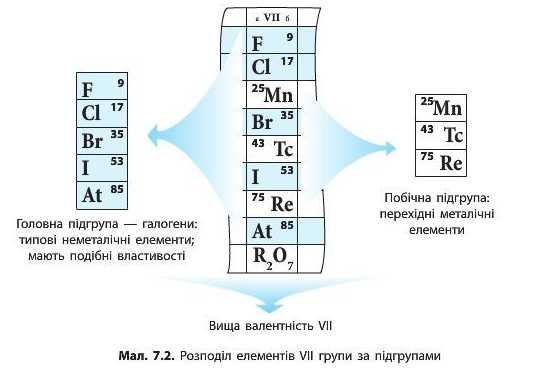
Побічні підгрупи містять тільки металічні елементи (їх називають перехідними металічними елементами). Головні підгрупи також називають A-групами, а побічні — В-групами. Наприклад: Флуор розташований у групі VIIA, а Манган — у групі VIIB (мал. 7.2).
У нижній частині періодичної таблиці розташовані родини лантаноїдів й актиноїдів. Це елементи, що мають бути розміщені після Лантану (№ 57) і Актинію (№ 89), і також належать до III групи (підгрупи Скандію). Однак розміщення цих елементів у таблиці зробило б її громіздкою і незручною, тому зазвичай їх виносять за її межі.
У більшості європейських країн користуються довгим варіантом періодичної таблиці, у якому число груп дорівнює 18. Номери груп у довгому варіанті таблиці позначають арабськими цифрами. У довгому варіанті головних і побічних підгруп немає, там вони утворюють окремі групи, наприклад: група 1 — лужні елементи, група 17 — галогени, група 18 — інертні елементи. Елементи побічних підгруп розміщені в групах від 3 до 12. Зверніть увагу, як співвідносяться номери груп у різних варіантах періодичної таблиці: номер групи в короткому варіанті дорівнює номеру в довгому мінус 10.
Властивості елементів у підгрупах
Підгрупи утворені елементами з подібними властивостями. Багато властивостей елементів закономірно змінюються в підгрупах зі збільшенням відносної атомної маси. У головних підгрупах при збільшенні атомної маси посилюються металічні властивості елементів і утворених ними простих речовин, а неметал Ічні — послаблюються. Так, у підгрупі Карбону (головна підгрупа IV групи) Карбон, Силіцій і Германій є неметалічними елементами, а Станум і Плюмбум — металічними.
Подібні властивості виявляють лише елементи, що належать до однієї підгрупи. Властивості елементів головної і побічної підгруп однієї групи можуть істотно відрізнятися. Наприклад, у VH групі є галогени — найтиповіші неметалічні елементи (головна підгрупа) і перехідні металічні елементи Манган, Технецій, Реній (побічна підгрупа) (мал. 7.2).
Чи є між ними щось спільне? Зазвичай, в елементів однієї групи однакова вища валентність, яку вони виявляють у сполуках з Окси-геном — вона дорівнює номеру групи.
Сполуки з Гідрогеном утворюють майже всі елементи, але леткі сполуки утворюють тільки неметалічні елементи. Такі сполуки є речовинами молекулярної будови. Металічні елементи не здатні утворювати летких сполук з Гідрогеном.
У сполуках з Гідрогеном неметалічні елементи виявляють свою нижчу валентність. Щоб її визначити, треба від 8 відняти номер групи. Наприклад, Хлор, що розташований у VII групі, у сполуці з Гідрогеном є одновалентним (8 — 7 = 1), тому формула цієї сполуки — НС1. Елемент V групи Фосфор у сполуці з Гідрогеном — тривалентний (8 — 5 = 3), тому формула сполуки — PHj.
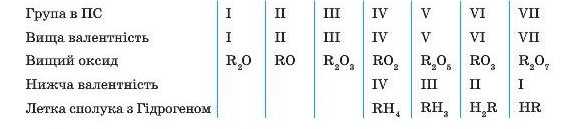
Для зручності загальні формули вищих оксидів і летких сполук з Гідрогеном винесені в окремі рядки періодичної таблиці (див. форзац). Слід пам’ятати, що формули летких сполук з Гідрогеном стосуються лише неметалічних елементів.
Латинське слово elementum використовували ще стародавні філософи. Давньоримський вислів гласив: «Як слова складаються з букв, так само і тіла — з елементів».
Висновки
1. Графічним відображенням Періодичного закону є Періодична система. Найпоширенішими є її короткий та довгий варіанти. Вони відрізняються числом рядків, що відводяться на один період. У довгому варіанті кожний період займає один рядок, а в короткому малі періоди розташовані в один рядок, а великі — у два.
2. Група хімічних елементів — це вертикальний стовпчик, що об'єднує елементи з подібними властивостями. У короткому варіанті Періодичної системи кожна група розділяється на головну та побічну. Головні підгрупи складаються з елементів усіх періодів, а побічні — тільки з елементів великих періодів.
Контрольні запитання
1. Чим розрізняються короткий і довгий варіанти Періодичної системи?
2. Що називають періодом, групою, головною і побічною підгрупою?
3. Як змінюються металічні та неметалічні властивості елементів у періодах? у головних групах?
4. Чому групи елементів у короткому варіанті Періодичної системи необхідно розділяти на головні і побічні підгрупи?
Завдання для засвоєння матеріалу
1. Назвіть хімічні елементи І групи Періодичної системи. Які з них належать до головної підгрупи, а які — до побічної?
2. У четвертому періоді, у п'ятій групі, у головній підгрупі Періодичної системи розташований: а) Силіцій; б) Станум; в) Арсен; г) Стибій.
3. Які з наведених елементів належать до головних, а які — до побічних підгруп: Нітроген, Оксиген, Гідроген, Купрум, Ферум, Алюміній?
4. Визначте в кожному наведеному ряду один хімічний елемент, що відрізняється від інших за місцем у Періодичній системі: а) Н, He, Ne, Аг;
6) Fe, Co, Ni, Аг; в) Н, Li, Be, В; г) F, Cl, Br, Mn.
5. Який хімічний елемент за властивостями подібний до Силіцію: а) Алюміній; б) Фосфор; в) Германій; г) Титан? Відповідь поясніть.
6. Складіть формулу вищого оксиду та формулу леткої сполуки з Гідрогеном (якщо вона існує) для таких елементів: а) Магній; б) Силіцій; в) Реній; г) Осмій; д) Телур; е) Радій.
7. У якого елемента сильніше виражені металічні (або неметалічні) властивості: а) у Бору чи Алюмінію; 6) в Арсену чи Нітрогену; в) Арсену чи Стибію? Відповідь обґрунтуйте.
8. Знайдіть у Періодичній системі елемент, що розташований у четвертому періоді та виявляє однакові валентності у вищому оксиді та у сполуці з Гідрогеном.
9. Порядкові номери хімічних елементів А, Б, і В дорівнюють відповідно η, п + 2, п + 4.
1) Якщо хімічний елемент А — найлегший галоген, то яким хімічним елементом буде Б?
2) Якщо хімічний елемент В — інертний, а Б — металічний, то яким хімічним елементом є А?
3) Якщо хімічні елементи А і Б належать до однієї групи, то яким хімічним елементом є В?
4) Чи можуть прості речовини, утворені А, Б і В, за звичайних умов бути газами?
10. Елементи А і Б належать до І групи, а елемент В — до Vll групи. Сполука елементів А і В розчинна у воді і забарвлює полум'я у фіолетовий колір, а сполука елементів Б і В має білий колір і нерозчинна у воді. Якими елементами можуть бути А, Б і В?
11. Визначте в Періодичній системі елемент, єдиний оксид якого має відносну молекулярну масу 40 ± 1, а валентність не більшу за IV. Доведіть, що існує лише один такий елемент.
12. Оксид елемента, що утворює з Гідрогеном летку сполуку зі складом RH4, містить 53,3 % Оксигену. Назвіть цей елемент.
13. Елемент, вищий оксид якого відповідає формулі ROj, утворює сполуку з Гідрогеном, що містить 2,47 % Гідрогену. Назвіть цей елемент.
14. Виконайте навчальний проект № 2 «Форми Періодичної системи хімічних елементів».
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:46, Переглядів: 7354