§ 6. Структура періодичної системи хімічних елементів
Опрацювавши параграф, ви дізнаєтеся:
як побудована періодична система; що таке період; як поділяють періоди; що таке група; як поділяють групи;
як змінюються властивості елементів у періодах і підгрупах; як за періодичною системою визначати валентність елементів у сполуках з Оксигеном і Гідрогеном.
Пригадайте з курсу хімії 7 класу, що кожний хімічний елемент розміщено у певній клітинці періодичної системи, у якій записана така інформація:
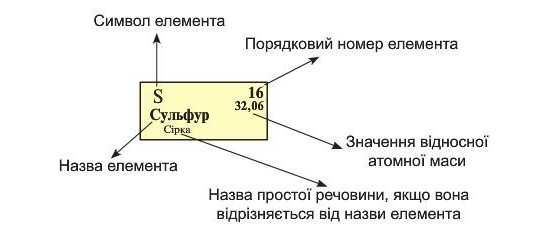
Базуючись на періодичному законі, Д.І. Менделєєв створив класифікацію хімічних елементів, яку називають періодичною системою. Зазвичай її відображають у вигляді таблиці, що складається з рядів і стовпчиків хімічних елементів.
1. Малі і великі періоди. Зміна властивостей елементів у періодах
Ряд хімічних елементів, розміщених у порядку зростання їх відносних атомних мас, який починається з Гідрогену або лужного елемента і закінчується інертним елементом, називають періодом.
Періоди нумерують арабськими цифрами.
Перший період містить лише два елементи, другий та третій — по вісім. Ці періоди називають малими.
Назвіть хімічні елементи третього періоду.
Як ви вже знаєте із попереднього параграфа, у періоді при переході від Гідрогену чи лужного елемента до інертного вища валентність елементів поступово зростає від І (у Гідрогену і лужних елементів) до VII (у галогенів). Якби вдалось отримати сполуки інертних елементів Неону та Аргону, то їх максимальна валентність мала би значення VIII.
У періоді змінюються також характер хімічних елементів (від металічних до неметалічних) і властивості утворених ними простих речовин (від металів до неметалів).
Назвіть металічні і неметалічні елементи 2 періоду.
На відміну від перших трьох періодів, четвертий і наступні (п’ятий, шостий, сьомий) містять по 18 і більше елементів. Ці періоди називають великими.
Четвертий період починається лужним елементом Калієм, за ним розміщений металічний елемент Кальцій. Наступні 10 металічних елементів (№21-30) називають перехідними елементами, за ними розміщені іще два металічні елементи — Ґалій і Германій, та елементи Арсен і Селен, що виявляють неметал Ічні властивості. Закінчують четвертий період типові неметалічні елементи — галоген Бром і інертний елемент Криптон. У четвертому періоді також спостерігається перехід від металічних елементів до неме-талічних. Вища валентність елементів поступово зростає, але на відміну від малих періодів, це відбувається двічі (див. таблицю 1).
Якщо ви були уважні, то помітили, що розміщуючи елементи в ряд, один раз знехтували принципом збільшення відносної атомної маси: інертний елемент Аргон (Ar(Ar) = 40) розміщений раніше лужного елемента Калію (Ar(K) = 39). В іншому випадку було би порушено принцип періодичності: адже інертний елемент завжди передує лужному. Як можна пояснити цей виняток? Річ у тім, що в основі періодичності лежить зміна не відносної атомної маси хімічних елементів, а іншої, принципово більш важливої їх характеристики. Д.І. Менделєєв не знав про її існування. Цю характеристику — заряд ядра — ми розглянемо трохи згодом.
2. Групи. Головні і побічні підгрупи
Якщо записати символи елементів кожного періоду в окремий рядок так, щоб природні родини (лужні, інертні елементи, галогени та інші) утворювали вертикальні стовпчики, то отримуємо довгий варіант періодичної системи (див. другий форзац підручника). Частіше використовують більш компактну коротку форму періодичної системи. У ній великі періоди поділені на два ряди, в кожному з яких вища валентність елементів послідовно зростає від І до VIII.
Вертикальні стовпчики періодичної системи називають групами.
У короткому варіанті (див. перший форзац підручника) таблиці таких груп вісім. Групи нумерують римськими цифрами.
Номер групи зазвичай співпадає з вищою (максимальною) валентністю хімічного елемента, яку він виявляє у сполуках з Окси-геном. Наприклад, Хлор і Манган, які розміщені в VII групі, мають вищу валентність VII, а елементи V групи Фосфор і Ванадій — валентність V
Яку вищу валентність у сполуках з Оксигеном виявляє Сульфур? Кожну групу ділять на дві підгрупи — головну (А) і побічну (В). Головна підгрупа містить елементи як малих, так і великих періодів, а побічна тільки великих періодів. Побічні підгрупи складаються лише з металічних елементів (їх називають перехідними елементами).
Назвіть порядкові номери хімічних елементів головної підгрупи другої
групи.
3. Зміна властивостей елементів у підгрупах
Підгрупи, утворені елементами із подібними властивостями,— відомі вам родини лужних, інертних елементів і галогенів — саме утворюють окремі підгрупи.
У якій групі розміщено галогени, лужні та інертні елементи?
Багато властивостей елементів закономірно змінюються у підгрупах із збільшенням відносної атомної маси. В головних підгрупах при збільшенні відносної атомної маси посилюються металічні властивості елементів і утворених ними простих речовин, а неме-талічні послаблюються. Наприклад, в головній підгрупі IV групи Карбон і Силіцій — неметалічні елементи, а Станум і Плюмбум — металічні.
Подібні властивості мають лише елементи, що належать до однієї і тієї ж підгрупи. Властивості елементів головної і побічної підгруп однієї групи можуть суттєво відрізнятись. Наприклад, у VII групі розміщені галогени — типові неметалічні елементи (головна підгрупа) і перехідні металічні елементи Манган, Технецій, Реній (побічна підгрупа) (мал. 1). Чи є у них щось спільне? Як правило, в елементів однієї і тієї ж групи однакова вища валентність, яку вони виявляють у сполуках з Оксигеном; вона дорівнює номеру групи.
3. Зміна властивостей елементів у підгрупах
Підгрупи, утворені елементами із подібними властивостями,— відомі вам родини лужних, інертних елементів і галогенів — саме утворюють окремі підгрупи.
Θ У якій групі розміщено галогени, лужні та інертні елементи?
Багато властивостей елементів закономірно змінюються у підгрупах із збільшенням відносної атомної маси. В головних підгрупах при збільшенні відносної атомної маси посилюються металічні властивості елементів і утворених ними простих речовин, а неме-талічні послаблюються. Наприклад, в головній підгрупі IV групи Карбон і Силіцій — неметалічні елементи, а Станум і Плюмбум — металічні.
Подібні властивості мають лише елементи, що належать до однієї і тієї ж підгрупи. Властивості елементів головної і побічної підгруп однієї групи можуть суттєво відрізнятись. Наприклад, у VII групі розміщені галогени — типові неметалічні елементи (головна підгрупа) і перехідні металічні елементи Манган, Технецій, Реній (побічна підгрупа) (мал. 1). Чи є у них щось спільне? Як правило, в елементів однієї і тієї ж групи однакова вища валентність, яку вони виявляють у сполуках з Оксигеном; вона дорівнює номеру групи.
Яку вищу валентність у сполуках з Оксигеном виявляють Хром і Селен?
4. Сполуки елементів з Гідрогеном
Крім сполук з Оксигеном, велике значення мають сполуки елементів з Гідрогеном. Вони відомі майже для всіх елементів періодичної системи, однак найбільш типові для неме-талічних елементів. Оскільки сполуки неметалічних елементів з Гідрогеном за звичайних умов перебувають у газуватому стані, їх називають «леткими». У сполуках з Гідрогеном валентність не-металічного елемента часто не співпадає з валентністю у вищому оксиді. Щоб її визначити, від восьми треба відняти номер групи. (Це значення валентності називають мінімальним). Наприклад, Хлор, розміщений у VII групі, у сполуці з Гідрогеном одновалентний: 8-7 = 1. Тому форму'ла його сполуки з Гідрогеном НС1. Елемент V груши Фосфор у сполуці з Гідрогеном тривалентний: 8-5 = 3, формула речовини PH3.
Для зрз'чності загальні формули вищих оксидів і летких сполук із Гідрогеном винесені в окремі рядки періодичної системи. Користуючись періодичною системою, запишіть формулу вищого оксиду Карбону і формулу його леткої сполуки з Гідрогеном.
5. Лантаноїди і актиноїди
У нижній частині періодичної системи розміщені лантаноїди (№ 58-№ 71) і актиноїди (№ 90-№ 103). Ці елементи повинні б}'ти розміщені після Лантану (№ 57) і Актинію (№ 89) і формально теж належати до III групи. Проте розміщення лантаноїдів і актиноїдів в таблиці зробило б її громіздкою і незручною, тому їх виносять за межі періодичної системи.
Користуючись періодичною системою, назвіть хімічні елементи з порядковими номерами 61, 67, 92 і 97. До яких груп хімічних елементів вони належать?
— ВИСНОВКИ
■ Періодична система має вигляд таблиці і складається з горизонтальних рядів (періодів) і вертикальних стовпчиків (груп).
■ Є сім періодів: три малих і чотири великих. Останні елементи, що завершують сьомий період, відкриті відносно недавно — у 2010 р.
■ Усього груп є вісім. Кожна група складається з головної (А) і побічної (Б) підгруп. У підгрупі розміщено елементи, подібні за хімічними властивостями.
■ У періоді властивості елементів, а також утворених ними простих речовин змінюються від металічних до неметалічних. У головних підгрупах згори донизу посилюються металічні властивості елементів і утворених ними простих речовин, а неметалічні послаблюються.
■ Валентність елемента у його сполуці з Оксигеном, як правило, збігається з номером групи, у якій він розміщений.
■ Неметалічні елементи утворюють леткі сполуки з Гідрогеном. Валентність неметалічного елемента у сполуці з Гідрогеном дорівнює різниці між числом 8 і номером групи, у якій розміщений елемент.
Початковий рівень
1. Поясніть, як побудована періодична система хімічних елементів.
2. Що називають: а) періодом; б) групою; в) головною і побічною підгрупою.
3. Чим відрізняються короткий та довгий варіанти періодичної системи?
4. Чому сьомий період називають незавершеним?
Середній рівень
5. Запишіть назви хімічних елементів І групи періодичної системи. Які з них належать до головної, а які до побічної підгрупи?
6. У яких періодах і в яких групах розміщені Нітроген, Оксиген, Гідроген, Купрум, Ферум, Алюміній? Які з цих хімічних елементів містяться в головних, а які — в побічних підгрупах?
7. Назвіть хімічний елемент, який розміщений у: а) 2 періоді, VII групі; б) 3 періоді, V групі; в) 4 періоді, головній підгрупі IV групи; г) 5 періоді, побічній підгрупі VI групи.
8. Укажіть відносну атомну масу хімічного елемента, який розміщений у: а) 1 періоді, VIII групі; б) 2 періоді, IV групі; в) 4 періоді, побічній підгрупі V групи; г) 5 періоді, головній підгрупі VII групи.
Достатній рівень
9. Із поданого переліку випишіть окремо металічні та немета-лічні елементи, а також укажіть їх розміщення (період, група, підгрупа) в періодичній системі: В, Mg, F, Mo, N, Zn, Si.
10. Як змінюються металічні властивості елементів: а) в періодах; б) в головних підгрупах?
11. Яку вищу валентність у сполуках з Оксигеном виявляють Плюмбум і Стибій?
12. Напишіть формули оксидів Калію, Магнію, Алюмінію.
Високий рівень
13. Знайдіть у періодичній системі найбільш активний метал і найбільш активний неметал.
14. Напишіть формули вищих оксидів і летких сполук з Гідрогеном: а) Силіцію; б) Арсену; в) Селену.
15. Укажіть пару хімічних елементів, що є найбільш подібними за хімічними властивостями до Барію:
A) Cs, La В) Ag, Au
Б) Hg, Cd Г) Sr, Ra
16. * За певних умов азот N2 вступає у реакцію з воднем H2 з утво
ренням леткої сполуки. Складіть рівняння цієї реакції. До якого типу вона належить?
Виконайте навчальні проекти
1. З історії відкриття періодичної системи хімічних елементів.
2. Форми періодичної системи хімічних елементів.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 08:08, Переглядів: 4252