§ 5. Періодичний закон Д.І. Менделєєва
Опрацювавши параграф, ви дізнаєтеся, що:
періодичний закон розкриває єдність хімічних елементів і взаємозв’язок між ними.
До середини XIX століття було відомо близько 60 хімічних елементів. Як ви вже знаєте, хіміки різних країн намагались їх класифікувати. Елементи з подібними властивостями були об’єднані у природні родини, вже знайомі вам: лужні, інертні елементи, галогени та інші. Створити єдину класифікацію хімічних елементів вперше вдалося професору Петербурзького університету Д.І. Менделєєв}'. Розташувавши символи усіх відомих на той час 63 хімічних елементів у порядку зростання їх відносної атомної маси, він помітив, що елементи зі схожими властивостями (наприклад, лужні елементи), не розміщені безпосередньо один за одним, а періодично (регулярно) повторюються. Виявилося, що так само закономірно через певний інтервал повторюється «хімічний характер» елементів.
Наслідуючи Д.І. Менделєєва, запишемо символи хімічних елементів у порядку зростання відносних атомних мас. Перший ряд розпочинає елемент з найменшою масою — Гідроген. Наступним є інертний елемент Гелій (Ar = 4), який на той час був невідомим:

Другий ряд розпочинається лужним елементом Літієм Li, а закінчується галогеном Флуором F і інертним елементом Неоном Ne:
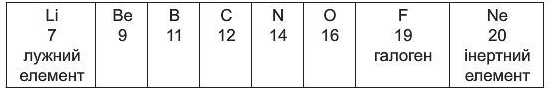
Наступні хімічні елементи утворюють ряд, дуже схожий на попередній:
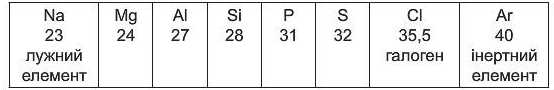
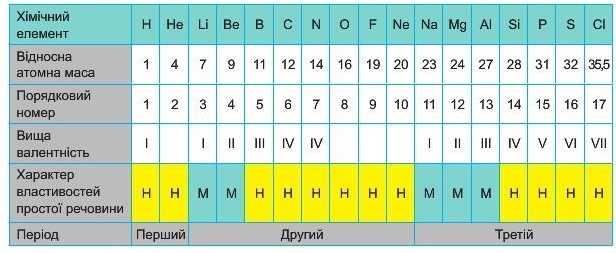
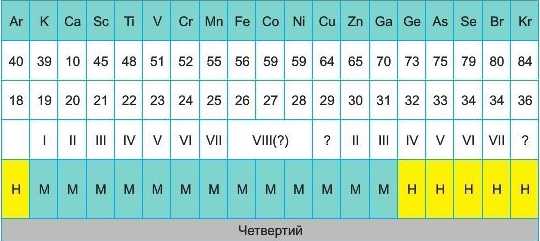
На початку ряду — хімічний елемент Натрій Na, який є, як і Літій, лужним елементом, а в кінці — галоген Хлор Cl та інертний елемент Аргон Аг. Послідовність перших 36 хімічних елементів відображена в таблиці 1 (див. стар. 26-27).
Пронумеруємо усі елементи по порядку, надавши кожному з них порядковий номер. (Згодом ви довідаєтесь, який фізичний сенс він має).
Поділимо ряд на 4 проміжки, які назвемо періодами, в межах яких відбувається перехід від металічного елемента до неметаліч-ного. (Детальніше, що таке «період», ви вивчатимете у наступному параграфі). У межах кожного період}' вища валентність елементів послідовно зростає.
Розглядаючи послідовність елементів, Д.І. Менделєєв побачив, що властивості елементів та їхніх сполук періодично повторюються залежно від їх відносної атомної маси. У 1869 р. він сформулював періодичний закон:
властивості хімічних елементів, а також утворених ними простих та складних речовин перебувають у періодичній залежності від відносних атомних мас елементів.
ПОСЛІДОВНІСТЬ ХІМІЧНИХ ЕЛЕМЕНТІВ, РОЗМІЩЕНИХ
— ВИСНОВКИ і
■ Періодичний закон відкрив Д.І. Менделєєв. Згідно з періодичним законом із зростанням відносної атомної маси властивості елементів та їхніх сполук змінюються періодично.
Початковий рівень
1. Хто відкрив періодичний закон?
Середній рівень
2. Сформулюйте періодичний закон.
3. Які ряди хімічних елементів називають періодами?
Достатній рівень
4. У якій частині кожного періоду розміщені елементи, що належать до: а)лужних елементів; б) галогенів; в) інертних елементів? Наведіть приклади.
5. Які властивості елементів та їхніх сполук змінюються періодично?
Таблиця I
У ПОРЯДКУ ЗБІЛЬШЕННЯ ВІДНОСНОЇ АТОМНОЇ МАСИ
Високий рівень
6. Для яких хімічних елементів найбільш характерні а) металічні б) неметалічні властивості. Наведіть приклади.
7. * Поміркуйте, який вираз більш вдалий: «періодичний закон»
чи «закон періодичності»?
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 08:07, Переглядів: 2034