§ 5. Поняття про галогени

Опрацювавши зміст параграфа, ви будете:
• знати фізичні й хімічні властивості галогенів;
• уміти складати рівняння відповідних реакцій;
• пояснювати характер зміни властивостей галогенів залежно від відносної атомної маси хімічних елементів.
До галогенів належать елементи Флуор F, Хлор СІ, Бром Br, Йод І, Астат At (радіоактивний елемент). Це ще одна природна родина подібних за властивостями хімічних елементів.
• Знайдіть за Періодичною системою елементи-га-логени.
Ці елементи утворюють прості речовини, які також називаються галогенами. Вони являють собою типові неметали.
Галогенам властиві леткість і надзвичайно висока хімічна активність. Вони вступають у взаємодію майже з усіма простимилш речовинами. Особливо швидко і з виділенням великої кількості теплоти відбувається сполучення галогенів із металами.

Дослід 1 (у витяжній шафі). У колбу, заповнену хлором, вносимо металічну ложку для спалювання речовин з розплавленим натрієм. В атмосфері хлору натрій згоряє зі сліпучим спалахом, а на стінках колби з’являється білий наліт натрій хлориду NaCl (мал. 2);
2Na + Cb = 2NaCl.
Мідь, залізо та багато інших металів згоряють у хлорі, утворюючи аналогічні сполуки (солі).
Дослід 2 (у витяжній шафі). На дно великої колби або банки насипаємо шар піску, аби колба (банка) не тріснула під час досліду, і всипаємо свіжоподрібнений порошок кристалічного ^ ^ стибію Sb. Він загоряється в хлорі яскравим
Горіння сти cb^tjiom* утворюючи білий дим - SbCb і SbCb бію в хяорі (отруйні) (мал. 3).
• Напишіть рівняння відповідних реакцій. Подібно взаємодіють з металами бром і йод.
За здатність безпосередньо сполучатися з металами з утворенням типових солей елементи Флуор, Хлор, Бром, Йод називають галогенами, що з грецької буквально означає «солеродні» (ті, що народжують солі).
Галогени взаємодіють із багатьма неметалами, у тому числі з воднем. Так, фтор F2 у суміші з воднем вибухає навіть у темряві й на холоді. Хлор Cb також вибухає з воднем, але на яскравому світлі або під час нагрівання (за стандартних умов без освітлення хлор практично не взаємодіє з воднем). Бром Br2 взаємодіє з воднем менш енергійно і лише під час нагрівання. Йод Ь реагує з воднем лише при досить сильному нагріванні й не повністю, оскільки утворений йодоводень НІ - нестійка сполука:

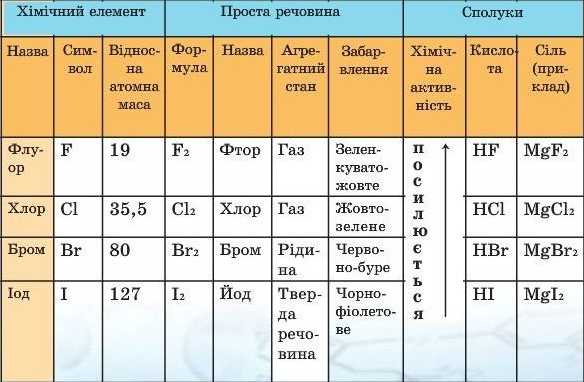
Хоча активність галогенів при цьому різна, та склад продуктів реакції однаковий: утворюються газуваті сполуки - гідроген галогеніди (галогєново-дні) HF, НС1, HBr, НІ, водні розчини яких є кислотами. Окремі властивості галогенів подано в табл. 2.
Таблиця 2
Властивості галогенів та сполук галогенів
Поступово вчені дізналися й про інші групи елементів, що мають подібні властивості. Так, одну групу подібних елементів утворили Нітроген, Фосфор, Арсен, Стибій, Вісмут, другу - Оксиген, Сульфур, Селен, Телур (див. Періодичну систему хімічних елементів).

Виявлення природних груп подібних за властивостями елементів стало важливим етапом на шляху розвитку класифікації хімічних елементів. Якщо першою класифікацією був поділ елементів на металічні й неметалічні (на підставі протилежних властивостей їх простих речовин -металів і неметалів), то далі було виявлено природні групи, всередині яких спостерігався зв'язок між елементами. Проте такі групи елементів розглядалися відособлено. Загального зв’язку між елементами ще не виявили. Адже було важко припустити, що між елементами, протилежними за властивостями, наприклад, між лужними елементами і галогенами, існує взаємозв’язок.
Але спроби робилися. Багато вчених намагалося розібратись у величезній кількості фактів. Так, у 1864 р. німецький хімік Юліус Лотар Мейєр опублікував таблицю, в якій йому вдалося із 63 відомих на той час елементів розмістити 27 за зростанням їхніх відносних атомних мас. Усі відомі елементи Мейєр внести у цю таблицю не зміг, оскільки для більшості з них ще не були визначені відносні атомні маси.
Історія розвитку хімії показала, що Ю. Л. Мейєр був на правильному шляху в своїх спробах класифікувати хімічні елементи. Адже він брав за основу єдину на той час загальну для всіх хімічних елементів фізичну величину -масу. Проте відкрити закон, який об’єднує всі елементи в струнку систему, вдалося у 1869 р. великому російському вченому, професору Петербурзького університету Д. І. Менделєєву.
Висновки
Галогени - природна родина елементів, що являють собою типові неметалічні елементи. Зі збільшенням відносної атомної маси цих елементів забарвлення простих речовин, які вони утворюють, темнішає й закономірно змінюється агрегатний стан від газуватої до твердої речовини.
Галогени активно взаємодіють з металами, утворюючи солі; з воднем, утворюючи газуваті галогеноводні, водні розчини яких є кислотами. Зі збільшенням відносної атомної маси хімічна активність галогенів послаблюється.
За властивостями прості речовини-галогени протилежні лужним металам: якщо галогени - типові неметали, то лужні метали - типові метали.
Багато спроб класифікації елементів зробили різні вчені, а успіху досяг російський учений Д. L Менделєєв, якому вдалося об’єднати всі елементи (подібні й відмінні за властивостями) в єдину систему хімічних елементів.
Завдання для самоконтролю
1. За якими ознаками хімічні елементи об’єднані: а) в родину лужних елементів; 6) у родину галогенів?
2. Напишіть рівняння реакцій, що ілюструють хімічні властивості галогенів.
3. Які властивості галогенів засвідчують, що вони є типовими неметалами?
4. За якими ознаками галогени відрізняються: а) один від одного; 6) від лужних металів? Відповідь мотивуйте.
5. Схарактеризуйте хімічні властивості брому. Сформулюйте закономірність зміни властивостей галогенів зі збільшенням відносної атомної маси.
6. Визначте, до якої родини належить хімічний елемент, якщо формула його оксиду R2O. Напишіть рівняння реакції, яка ілюструє хімічні властивості цього оксиду.
Додаткові завдання
7. В одну з природних груп елементів були об’єднані Кальцій, Стронцій та Барій, які дістали назву лужноземельних елементів. Знайдіть їх у Періодичній системі хімічних елементів, напишіть формули їх оксидів та гідроксидів і зазначте назви цих сполук.
8. Напишіть символи й назви інертних елементів (благородних газів) і поясніть їхню назву.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:09, Переглядів: 3983