§ 25. Розрахунки за рівняннями хімічних реакцій
Опрацювавши зміст параграфа, ти будеш:
• знати алгоритм розв’язування розрахункової задачі;
• вміти обчислювати масу речовини за відомою масою іншої речовини або кількістю речовини; кількість речовини за відомою масою, об’єм газуватої речовини (н. у.) за відомою масою або кількістю речовини.
Ви вже знаєте, що хімічне рівняння - умовний запис хімічної реакції за допомогою хімічних формул. Його складають на основі закону збереження маси речовин, згідно з яким маса речовин, що вступають у реакцію, дорівнює масі речовин, які утворюються внаслідок реакції. Добираючи коефіцієнти до формул речовин, ми зрівнюємо число атомів кожного елемента в лівій та правій частинах і дістаємо хімічне рівняння, що відповідає закону збереження маси.
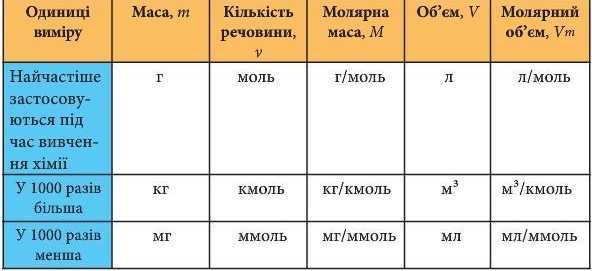
За хімічним рівнянням можна робити різні розрахунки - обчислювати кількість речовин, масу, об’єм вихідних речовин або продуктів реакції. Для цього потрібно спочатку записати скорочену умову задачі, правильно використовуючи фізичні величини та їх позначення (табл. 9).
Таблиця 9
Співвідношення деяких фізико-хімічних величин та одиниць
вимірювання
Розглянемо конкретні приклади.
Приклад 1. Яку масу гашеного вапна можна добути внаслідок взаємодії з водою кальцій оксиду масою 280 г?
Передусім записуємо скорочену умову задачі та складаємо рівняння хімічної реакції.

Варіант 1. Прочитайте ще раз умову задачі й у хімічному рівнянні підкресліть відоме (що дано) і невідоме (що треба дізнатися). Над підкресленими формулами проставляємо вихідні дані з умови задачі:
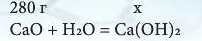
Під формулами речовин записуємо дані, які можна дістати з рівняння реакції:
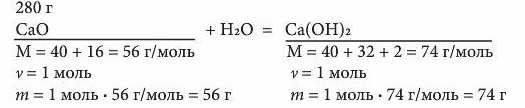
З рівняння реакції виходить, що внаслідок взаємодії з водою 56 г CaO можна добути 74 г Са(ОН)г, а з 280 г CaO можна добути гашеного вапна у стільки разів більше, у скільки 280 г більше за 56 г. Тобто ми бачимо, що між величинами існує пряма пропорційна залежність. Отже, ми можемо скласти пропорцію і розв’язати її.

З рівняння реакції видно, якщо взаємодіє з водою кальцій оксид CaO кількістю речовини 1 моль, то й утворюється кальцій гідроксид Са(ОН)г кількістю речовини 1 моль. Отже, якщо в реакцію вступає кальцій оксид кількістю речовини 5 моль, той утворюється кальцій гідроксид кількістю речовини 5 моль, тобто:
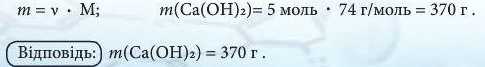
Приклад 2. Яка кількість речовини нітроген(У) оксиду прореагувала з водою, якщо утворилася нітратна кислота HNOs кількістю речовини 10 моль?
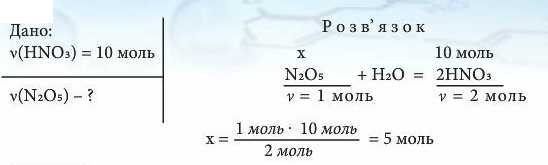
(Відповідь:)Якщо утворилася нітратна кислота ΗΝΟ3 кількістю речовини 10 моль, то з водою прореагував нітроген(У) оксид кількістю речовини 5 моль, отже v(N20s) = 5 моль.
Приклад 3. Який об’єм кисню (н. у.) необхідний для окиснення алюмінію масою 54 г?

(Відповідь)Для окиснення алюмінію масою 54 гнеобхідно витратити кисень об’ємом 33.6 л (н.у.). Отже, У(Ог) = 33,6 л.
Варіант 2:
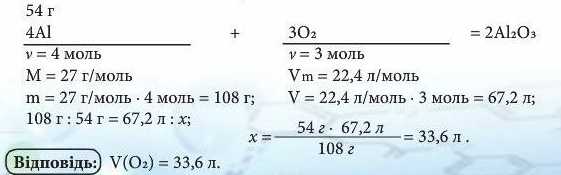
Виконуючи дії з іменованими числами і використовуючи при цьому будь-які зручні одиниці виміру, стежте за тим, у яких одиницях має надаватися відповідь.
Зверніть увагу, майже кожна хімічна задача може бути розв’язана кількома способами. Намагайтесь знаходити різні варіанти розв’язування конкретної задачі, але обирайте той з них, який є найраціональнішим.
Для розв’язування розрахункової задачі можна використовувати такий алгоритм:
1. Записуємо скорочені умови задачі.
2. Складаємо рівняння хімічної реакції.
3. Підкреслюємо в рівнянні формули речовин, про які йдеться в умові задачі (відомої і невідомої).
4. Над формулами речовин з умови задачі надписуємо відому величину і невідому з відповідними одиницями вимірювання (йдеться лише про чисті речовини, без домішок).
5. Під формулами речовин з відомою і невідомою величинами записуємо відповідні значення цих величин, визначені за рівнянням реакції.
6. Складаємо й розв’язуємо пропорцію на підставі двох даних, узятих з рівняння реакції, і двох даних - з умови задачі.
7. Записуємо повне формулювання відповіді.
Висновки
Рівняння хімічної реакції відображає матеріальний баланс процесу,
тому дає змог)' здійснювати розрахунки маси, об’єму або кількості речо-• ··· ·
вини продуктів реакції чи вихідних речовин.
Щоб розв’язати хімічну задачу треба правильно написати формули речовин, вміти правильно скласти рівняння хімічної реакції і пам’ятати, що розв’язування задачі будується на використанні прямо пропорційної залежності між кількісними характеристиками величин.
Для розв’язування задачі треба знати формули, що виражають зв'язок між фізичними величинами (див. форзац).
Можна використовувати будь-які величини, але для кожної з речовин (взятої чи з умови задачі, чи з рівняння реакції) потрібно застосовувати одну й ту саму величину.
Завдання для самоконтролю
1. У виробництві гуми як наповнювач використовують сажу (являє собою майже чистий вуглець). Її добувають неповним спалюванням природного газу метану CH i за рівнянням:
CH4 + O2 = C + 2НЮ.
Обчисліть масу метану, необхідного для добування сажі масою 1000 т.
2. У наслідок взаємодії магнію кількістю речовини 0,1 моль з киснем утворюється магній оксид масою:
А 1г; Б 2 г; В Зг; Г 4г.
3. Якщо в кисні спалити 4 г кальцію, то при цьому утвориться кальцій оксид масою:
А 112 г; Б 11,2 г; В 5,6 г; Г 5,8 г.
4. Якщо утворився купрум(ІІ) оксид масою 4 г, то з міддю прореагував кисень кількістю речовини і масою:
А 0,025 моль, 8 г; Bl моль, 160 г;
Б 0,05 моль, 1,6 г; Г 2 моль, 320 г.
5. Об’єм вуглекислого газу, що утворюється внаслідок повного згоряння вуглецю кількістю речовини 0,3 моль, становить:
А 3,36 л; Б 6,72 л; В 13,44 л; Г 22,2 л.
Додаткові завдання
6. Обчисліть маси ртуті й кисню, необхідні для добування мєркурій(ІІ) оксиду кількістю речовини 0,1 моль.
7. В якому випадку витратиться більший об’єм кисню (н. у.) - у разі окиснсння літію кількістю речовини 1 моль чи спалювання такої ж кількості речовини кальцію? Відповідь обґрунтуйте розрахунком.
8*.У зерносховищах для звільнення приміщення від шкідників зерна часто спалюють сірку з розрахунку, аби кожний кубічний метр повітря містив не менш, як 50 г сульфур(ІУ) оксиду. Обчисліть масу сірки, яку необхідно спалити в приміщенні об’ємом 5000 м3.
9*. Барій спалили в кисні (н. у.) об’ємом 5,6 л. Яку масу барій гідроксиду можна добути з утвореного оксиду?
10*. Фосфор масою 248 г спалили в кисні. Утворений оксид прокип’ятили з водою. Яка кількість речовини (і якої) з фосфатних кислот утворилася при цьому?
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:21, Переглядів: 4062