§ 31. Розрахунки за рівняннями хімічних реакцій
Пригадайте способи обчислення кількості речовини за відомою масою або об’ємом (за § 24-26).
Коли кухар готує будь-яку страву, він відповідно до рецепта, змішує продукти в чітко визначеному співвідношенні. Так само й хімік, перед проведенням хімічної реакції має вирішити, у якому масовому співвідношенні слід змішати реагенти та обчислити масу продукту, що має утворитися.
Такі розрахунки можна провести за допомогою рівнянь хімічних реакцій. Якщо відомо масу одного з учасників реакції, то можна визначити маси всіх інших речовин — і реагентів, і продуктів реакції.
Хімічне рівняння показує, які речовини та в якому співвідношенні взаємодіють, а також у якому співвідношенні утворюються продукти реакції. Наприклад, рівняння реакції взаємодії водню з азотом
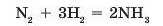
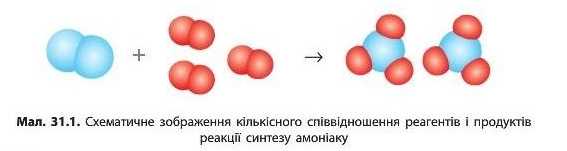
показує, що три молекули водню H., взаємодіють з однією молекулою азоту N2 з утворенням двох молекул амоніаку NH3 (мал. 31.1).
Таке саме співвідношення буде і для кількості речовини всіх сполук у реакції: три моля водню вступає в реакцію з одним молем азоту, і при цьому утворюється два моля амоніаку.
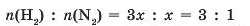
Якщо для проведення реакції взяти не три моля водню, а будь-яку іншу кількість (наприклад, Sx моль), то кількість азоту, що прореагував, буде в три рази меншою, ніж кількість водню, тобто w(N ) = X моль:
Отже, речовини вступають у хімічні реакції в кількостях, що пропорційні їхнім коефіцієнтам у рівнянні реакції (стехіометричним коефіцієнтам). Іншими словами, відношення кількостей реагентів (у молях) дорівнює відношенню відповідних коефіцієнтів у рівнянні реакції.
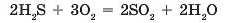
З нього видно, що два моля сірководню реагує із трьома молями кисню з утворенням двох молей сірчистого газу і двох молей води. Якщо в реакцію вступає х моль сірководню, то співвідношення реагентів і продуктів реакції виглядає так:
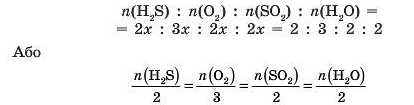
Отже, для будь-якої хімічної реакції, що можна описати рівнянням:
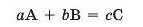
справедливо співвідношення для кількості речовини всіх учасників реакції:
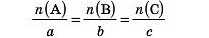
За цим співвідношенням можна робити будь-які обчислення за рівнянням хімічної реакції.
Задача 1. Яка кількість речовини кисню необхідна для спалювання сірководню кількістю 1,5 моль?

При проведенні реакцій потрібно знати не тільки кількості речовин, але й їхні маси або об’єми. Ці величини зв’язані співвідношеннями:
т = η · M V = η · V
т
Але задачі за рівняннями хімічних реакцій простіше розв’язувати з використанням кількості речовини. Якщо в умові задачі наведені маса або об’єм речовини, зручніше одразу обчислити кількість речовини й далі використовувати цю величину для розрахунків.
Задача 2. Обчисліть масу фосфор(У) оксиду, який можна добути спалюванням фосфору в кисні об’ємом 11,2 л (н. у.).

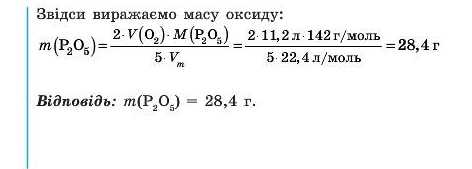
Задача 3. Обчисліть об’єм азоту (н. у.), необхідний для добування амоніаку NH3 кількістю 0,8 моль.

Задача 4. Просту речовину масою 10,8 г спалили, на що витратили кисень об’ємом 6,72 л (н. у.). У результаті утворився оксид зі складом E2O3. Яку речовину спалили?

Хімічні речовини вступають у хімічні реакції в певних, чітко визначених співвідношеннях. Кількості речовин усіх учасників реакції співвідносяться як їхні стехіометричні коефіцієнти в рівнянні реакції. Для реакції йА + ЬВ = сС справедливе співвідношення:
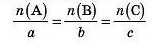
Завдання для засвоєння матеріалу
1. Проаналізуйте рівняння реакції горіння метану подібно до того, як це зроблено в цьому параграфі для реакції горіння сірководню.
2. У якому кількісному співвідношенні слід змішати залізо із сіркою для добування ферум(ІІ) сульфіду?
3. Визначте співвідношення кількості речовини реагентів для добування купрум(ІІ) оксиду з простих речовин.
4. Обчисліть кількість речовини фосфор(\/) оксиду, що утвориться при згорянні фосфору кількістю речовини 2 моль. Яка кількість речовини кисню витрачається при цьому?
5. Визначте кількість речовини кальцій гідроксиду, що утворюється при взаємодії води з: а) 0,5 моль кальцій оксиду; 6) 8 г кальцій оксиду.
6. Складіть рівняння реакції згоряння амоніаку NHi у кисні з утворенням азоту і води. Обчисліть об'єм кисню (н. у.), що необхідний для спалювання амоніаку кількістю 24 моль. Який об’єм (н. у.) кожного з продуктів реакції при цьому утворюється?
7. Обчисліть масу кальцій карбонату, що утворюється при взаємодії карбон(І\/) оксиду об'ємом 11,2 л (н. у.) з кальцій оксидом.
8. Обчисліть масу сульфур(\/І) оксиду, необхідну для добування сульфатної кислоти масою 4,9 г.
9. Обчисліть масу гідроген пероксиду, необхідну для добування кисню об'ємом 5,6 л (н. у.).
10. Кар6он(І\/) оксид можна добути спалюванням вуглецю або спалюванням метану. Обчисліть, якої речовини й у скільки разів більше (за масою) необхідно для добування карбон(І\/) оксиду об'ємом 28 л (н. у.).
11. Обчисліть масу ортофосфатної кислоти, що утворюється при взаємодії фосфор(\/) оксиду масою 1 кг з водою.
12. При пропусканні сульфур(ІУ) оксиду крізь розчин барій гідроксиду утворилася сіль масою 43,4 г. Обчисліть об'єм (н. у.) витраченого газу.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 18:02, Переглядів: 7000