§ 8. Будова атома. Фізичний зміст Періодичного закону


Опрацювавши зміст параграфа, ви будете:
• мати уявлення про радіоактивність;
• розуміти фізичний зміст Періодичного закону; порядкового номера хімічного елемента;
• знати сучасне формулювання Періодичного закону, склад атомних ядер;
• уміти визначати кількість протонів і нейтронів у ядрі атома.
Вам вже відомо, що Д. І. Менделєєв узагальнив великий обсяг знань і відкрив фундаментальний закон природи - Періодичний закон. Але рівень тогочасної науки не дав змоги розкрити фізичний зміст Періодичного закону, виявити причини періодичної зміни властивостей елементів залежно від зростання їхніх атомних мас. Це стало можливим лише після з’ясування будови атома.
У науці довго панувала думка, що атоми - найменші частинки речовини і не містять інших, простіших складових частинок, том)' вони неподільні
і не можуть перетворюватися на інші атоми. Проте наприкінці XIX ст. фізики експериментально підтвердили складність будови атома. Відкриття рентгенівських променів (1895 р.), явища радіоактивності (1896 р.), електрона (1897 р.) спричинили революцію в природознавстві, зокрема сприяли перегляду уявлень про структуру і властивості речовини, оскільки атом виявився складним утворенням. Саме відкриття радіоактивності відіграло велику роль у встановленні природи атома й розкритті його структури.
Поняття про радіоактивність
Досліджуючи солі Урану, французький фізик А. Бекке-рель виявив, що елемент Уран випромінює невидимі для ока промені, подібні до рентгенівських. Його дослідами зацікавилися інші вчені.
Зокрема, Марія Склодовська-Кюрі встановила, що сполуки Торію Th також мають цю здатність. Разом зі своїм чоловіком вона відкрила два нові елементи, названі за її пропозицією Полонієм Po (від лат. Polonia - Польща) і Радієм Ra (від лат. radius - промінь), які виявилися значно потужнішими джерелаліи випромінювання, ніж Уран і Торій. Таку здатність деяких елементів назвали радіоактивністю, а елементи - радіоактивними.
Вивчаючи природу радіоактивного випромінювання, англійський фізик Ернест Резерфорд установив, що воно неоднорідне: під дією електричного поля поділяється на три пучки, один з яких не змінює свого початкового напряму, отже, не несе електричного заряду, - це у-ви-промінювання (електромагнітні хвилі), а два інші - відхиляються у протилежні боки до зарядів електричного поля (мол. 4). Це α-проміння (ядра атомів елемента Гелію) і ^-проміння (потік електронів).
Вчення про радіоактивність підтвердило складність будови атома.
Будова атома. Вивчаючи розсіювання α-частинок, які проходять крізь тонкі металеві пластинки, Е. Резерфорд у 1911 р. запропонував схему будови атома, що дістала назву ядерна модель атома. Згідно з цією моделлю атом
складається з позитивно зарядженого ядра і негативно заряджених електронів, що обертаються навколо нього. Позитивний заряд ядра нейтралізується сумарним негативним зарядом електронів, тому атом загалом електро-нейтральний.
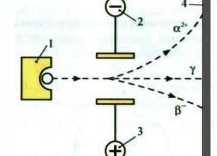
Мал. 4. Дія електричного поля на радіоактивне випромінювання: 1 - джерело випромінювання у свинцевому контейнері; 2 - катод; 3 - анод; 4 - екран для реєстрування випромінювання (вкритий речовиною, що може світитися під впливом якогось джерела енергії).
Порядковий номер елемента - заряд ядра його атома. Численні експериментальні дослідження англійських учених (Е. Резерфорда, Г. Мозлі, 1917 р.) показали, що
заряд ядра атома дорівнює порядковому номеру елемента в Періодичній системі.

Так було розкрито фізичний злііст порядкового номера. Він виявився дуже важливою константою, що виражає величину заряд}7 ядра. Оскільки атом загалом електроней-тральний, то й число електронів у атомі також дорівнює порядковому номеру елемента. Наприклад, порядковий номер елемента Фсруму - 26. Це означає, що заряд ядра його атома +26, а оскільки атом електронейтральний, то й електронів має бути 26, сумарний негативний заряд яких становить -26(заряд електрона - найменший негативний заряд, прийнятий за одиницю).
Відкриття фізичного змісту порядкового номера дало нове обґрунтування розміщенню елементів у Періодичній системі.
З’ясувалося, що елемента розміщені не стільки за зростанням атомної маси, скільки за зростанням заряду ядер їх атомів. Дістала пояснення й удавана суперечність у системі Д. І. Менделєєва - розміщення трьох пар елементів (Аргон і Калій, Кобальт і Нікель, Телур і Йод) не в порядку зростання їх атомних мас, а навпаки. Виявилося, що таке розміщення відповідає величині зарядів ядер атомів цих елементів. Отже, суперечності немає.
Завдяки відкриттю фізичного значення порядкового номера Періодичний закон Д. І. Менделєєва нині формулюється так:
властивості елементів і утворених ними простих і складних речовин перебувають у періодичній залежності від величини заряду ядер їх атомів.
Уточнення формулювання Періодичного закону - необхідний наслідок дальшого розвитку пізнання. Періодичний закон - це об’єктивний закон природи. Він реально існує і діє незалежно від людської свідомості, а його формулювання відображає рівень розуміння людством цього закону. З часом формулювання законів (як і понять) може змінюватись, якщо нові відкриття дають змогу глибше зрозуміти їхню суть. Саме так відбулось і з Періодичним законом, у зв'язку з чим виникла необхідність уточнення його формулювання. Приклад із формулюванням Періодичного закону дає вам змогу зрозуміти закономірності процесу пізнання: від вивчення й узагальнення фактів - до виявлення закону природи і далі до пояснення цього закону на підставі нових фактів.
Висновки
Наукові відкриття наприкінці XIX ст. - відкриття рентгенівських променів, радіоактивності, електрона - сприяли перегляду поглядів на атом як найпростішу, найменшу частинку речовини.
Атом - складне утворення. Він складається з позитивно зарядженого ядра і негативно заряджених електронів.
Величина заряду ядра атома дорівнює порядковому номеру елемента в Періодичній системі.
Елементи в Періодичній системі розміщені за зростанням величини заряду ядер їхніх атомів.
Властивості елементів та їх сполук перебувають у періодичній залежності від величини заряду ядер їхніх атомів.
Завдання для самоконтролю
1. У чому полягає суть радіоактивності? Хто і як відкрив це явище? Назвіть два - три радіоактивні елементи.
2. Що являє собою атом? Хто вперше запропонував модель атома?
3. У чому полягає фізичний зміст порядкового номера елемента?
4. Визначте заряд ядра атомів Нітрогену, Неону, Магнію, Сульфуру і число електронів у атомах цих елементів.
5. Наведіть сучасне формулювання Періодичного закону і порівняйте його з менделєєвським (див. § 5). Як ви думаєте, чи принижує велич мєн-делєєвського відкриття зміна з часом формулювання відкритого ним закону? Відповідь обґрунтуйте.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:11, Переглядів: 2183