§ 9. Атом: ядро плюс електрони
Встановлення складної будови атомів
Вам вже відомо, що всі речовини складаються з атомів, молекул або йонів. У свою чергу, молекули та йони утворюються з атомів.
Тривалий час уважалося, що атом неможливо розділити на дрібніші частинки. До початку XX ст. була відома лише одна кількісна характеристика атомів — відносна атомна маса, що була взята за основу класифікації хімічних елементів. Однак, використовуючи тільки масу атомів, не можна було пояснити причини періодичності зміни їхніх властивостей. Було незрозуміло, чому атоми з близькими масами, наприклад Алюміній і Силіцій, істотно відрізняються за властивостями, тимчасом як атоми з різними масами можуть мати подібні властивості. Отже, для характеристики атомів знання лише їхньої маси недостатньо. Усе це наводило вчених на думку про те, що атом має складну будову. На початку XX ст. було висловлено багато гіпотез щодо моделі внутрішньої будови атома, деякі з яких представлені на малюнку 9.1.
Найбільших успіхів у дослідженні атома досяг англійський учений Ернест Резерфорд. У 1909 р. він провів експеримент, у якому бомбардував золоту фольгу позитивно зарядженими альфа-частинками. Більшість із них, проходячи крізь фольгу, не відхилялися від початкового напрямку, деякі трохи відхилялися, а невелика кількість альфа-частинок значно відхилялася від початкової траєкторії і іноді
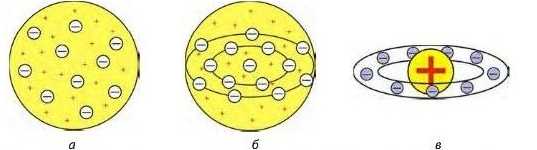
Мал. 9.1 .а — «кексова» модель атома Вільяма Томсона (1902 р.), він уявляв атом як згусток позитивно зарядженої матерії, у якому рівномірно розподілені електрони, наче родзинки в кексі; б — «кексова» модель, удосконалена Джозефом Джоном Томпсоном (1904 р.), у якій електрони розташовані в одній площині й утворюють концентричні кільця; в — модель атома Хантаро Нагаока (1904 р.), він припустив, що атом схожий на планету Сатурн — половину об'єму займає позитивно заряджена куля, навколо якої супутники-електрони утворюють кільце
Англійський фізик, лауреат Нобелівської премії з хімії 1908 р. Народився в Новій Зеландії в родині колісного майстра. Працював у Кембриджі, у лабораторії Кавендіша під керівництвом Томсона. Резерфорд є засновником нового напрямку науки — ядерної фізики. Він створив учення про радіоактивність та будову атома Запропонував нову, революційну на той час теорію будови атома, яка сьогодні є загальновизнаною. Цим він спростував ідею про неподільність атома і приголомшив увесь світ ідеєю, що всі тіла (навіть найтвердіші) є здебільшого порожнім простором, у якому рухаються крихітні частинки. Здійснив першу штучну ядерну реакцію і продемонстрував можливості використання ядерної енергії. Передбачив існування нейтрона.

навіть летіли у зворотному напрямку. Резерфорд писав, що це було так дивно, ніби ви вистрілюєте з гармати в лист паперу, а гарматне ядро відбивається від нього і летить назад вам у чоло.
Результати цього експерименту суперечили популярним на той час моделям атомів. Якби «кексова» модель атома відповідала дійсності, то альфа-частинки мали б вільно проходити крізь атоми золотої фольги (мал. 9.2). Оскільки альфа-частинки заряджені позитивно, то для того, щоб відбиватися від фольги, вони мають стикатися з іншими позитивно зарядженими частинками у складі атомів, які утворюють золоту фольгу. Ґрунтуючись на результатах свого експерименту, Резерфорд довів, що позитивний заряд в атомі сконцентрований у центрі атома в дуже невеликому об’ємі, який він назвав ядро.·».
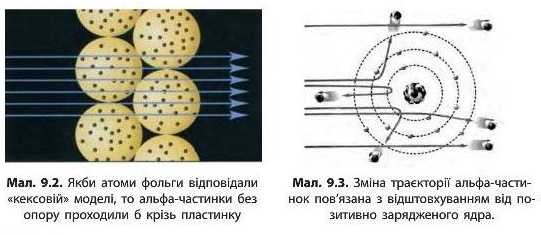
У ході експерименти чим ближче до ядра пролітали альфа-частинки, тим сильніше викривлялася їхня траєкторія, а частинки, що влучили прямо в ядро, відбивалися від нього й летіли назад (мал. 9.3).
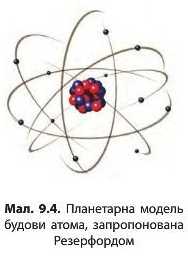
Резерфорд запропонував свою — планетарну — модель будови атома, якою з невеликими змінами ми користуємося до сьогодні (мал. 9.4). Згідно з цією моделлю весь позитивний заряд атома зосереджений у центрі — ядрі — яке оточено негативно зарядженими електронами. Електрони рухаються навколо ядра певними орбітами, наче планети навколо Сонця.
Атом — це електронейтральна хімічно неподільна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Модель атома Резерфорда, без сумніву, найбільш відповідала дійсній будові атома, але й вона мала суттєве протиріччя: відповідно до законів фізики електрон, якщо він обертається навколо ядра, має безперервно випромі- 1 нювати енергію й із часом впасти на ядро. Модель атома Резерфорда удосконалив данський фізик Нільс Бор. Він стверджував, що електрони можуть обертатися не на будь-якій орбіті, а тільки на певних визначених відстанях від ядра, утворюючи концентричні сфери з електронів. Тому іноді планетарну модель атома називають моделлю Бора-Резерфорда.
Склад атомів
Отже, атоми складаються з позитивно зарядженого ядра та негативно заряджених електронів.
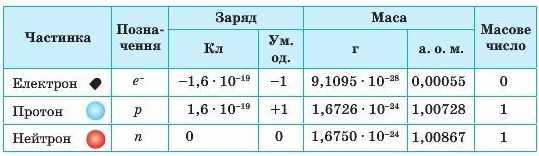
Електричний заряд електрона називають елементарним, оскільки він найменший з усіх відомих зарядів і тому його абсолютну величину приймають за одиницю вимірювання. Саме в цих умовних одиницях зазвичай указують заряди всіх частинок: електронів, протонів, ядер, йонів тощо. Заряд самого електрона приймають за 1 (табл. δ, с.48).
Електрон — найлегша з відомих елементарних частинок. Його маса становить 9,1 · 10 31 кг, це в 1837 разів менше за масу найлегшого з атомів атома Гідрогену. Часто в розрахунках масою електрона нехтують (вважають такою, що дорівнює нулю).
Після встановлення складної будови атома було з’ясовано, що ядро атома також має складну будову. Воно складається із частинок двох видів — протонів і нейтронів (мал. 9.5). Протони й нейтрони називають нуклонами. Протони є позитивно зарядженими частинками із зарядом +1, а нейтрони не мають заряду (табл. 5). Це означає, що весь позитивний заряд ядра утворений лише протонами — їх число дорівнює заряду ядра:
Таблиця 5. Частинки, з яких складається атом
число протонів в ядрі = заряд ядра
Будь-який атом є електронейтральним, тож число протонів із зарядом +1 завжди дорівнює числу електронів із зарядом —1:
число протонів в ядрі = число електронів в електронній оболонці
Ядро — найважча частинка атома: його маса становить близько 99,97 % від маси атома і визначається числом протонів і нейтронів в ядрі. Маси протона й нейтрона майже однакові і приблизно дорівнюють 1 а. о. м. Отже,
відносна атомна маса = масове число =
= число протонів + число нейтронів
Приклад. Ядро атома містить 5 протонів та 5 нейтронів.
1. Визначимо заряд ядра та число електронів в атомі:
Число протонів в ядрі = 5 —> Заряд ядра = +5 —•» Число електронів = 5
2. Визначимо відносну атомну масу:
Число протонів = 5 Маса протонів = 5 а. о. м.
.. v . „ . Маса ядра атома= 10 а. о. м.
Число нейтронів = 5 Маса нейтронів = о а. о. м.
. . Маса атома = 10 а. о. м.
Число електронів = 5 Маса електронів = 0
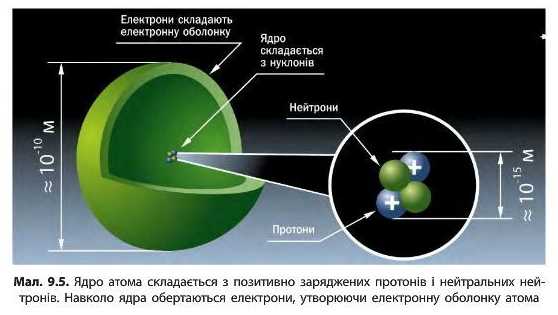
І хоча саме в ядрі зосереджена вся маса атома, проте розміри ядра надзвичайно малі: його радіус приблизно в сто тисяч разів менший за радіус атома (мал. 9.5). Уявіть, якщо розмір ядра збільшити до розміру звичайного яблука, то сам атом буде розміром із земну кулю.
Порядковий номер хімічного елемента
В усіх атомів одного хімічного елемента число протонів завжди однакове (і дорівнює заряду ядра), а число нейтронів може бути різним, тому маса атомів одного елемента також може бути різною. Це означає, що не маса, а саме заряд ядра є основною характеристикою, що відрізняє атоми одного виду від атомів іншого виду. Завдяки цьому на початку XX ст. змінилося визначення поняття хімічного елемента, яке існувало ще з часів Роберта Бойля.
Хімічний елемент — це різновид атомів з однаковим зарядом ядра.
Після відкриття складної будови атома було змінено й формулювання Періодичного закону:
Властивості хімічних елементів, а також утворених ними речовин перебувають у періодичній залежності від зарядів їхніх атомних ядер.
Подальше вивчення будови атома виявило, що протонів в атомах міститься не довільне число, а таке, що дорівнює порядковому номеру хімічного елемента в Періодичній системі хімічних елементів Д. І. Менделєєва. Отже і заряд ядра також дорівнює порядковому номеру:
число протонів в ядрі = заряд ядра = порядковий номер елемента
Виявилось, що, навіть не здогадуючись про складну будову атомів, Менделєєв під час складання своєї Періодичної системи розташував елементи за порядком збільшення зарядів їхніх атомних ядер.
• Фізики впевнені, що протони, нейтрони та інші частинки складаються з кварків — справжніх елементарних частинок. Однак ученим ніяк не вдається відокремити кварки й у такий спосіб остаточно довести їх існування. Але електрон дотепер вважається елементарною частинкою.
• Ернест Резерфорд проводив дослідження переважно в галузі фізики й одного разу заявив, що всі науки можна розділити на дві групи — на фізику та колекціонування марок. Однак Нобелівську премію Резерфорд здобув саме з хімії, що було несподіваним як для нього, так і для інших учених. Пізніше він зазначив, що з усіх перетворень, що йому вдалося спостерігати, найшвидшим виявилося власне перетворення з фізика на хіміка.
Висновки
1. Загальноприйнятою є планетарна модель будови атомів, згідно з якою атом складається з позитивно зарядженого ядра, навколо якого на певній відстані обертаються негативно заряджені електрони, утворюючи електронну оболонку атома.
2. Ядро атома складається з нуклонів: позитивно заряджених протонів та нейтральних нейтронів. Число протонів в ядрі певного атома дорівнює порядковому номеру відповідного хімічного елемента в Періодичній системі. Оскільки атом електронейтральний, то число протонів в ядрі атома дорівнює числу електронів в електронній оболонці.
Контрольні запитання
1. Схарактеризуйте планетарну модель атома Резерфорда.
2. Які частинки містяться у складі: а) атома; б) атомного ядра? Який вони мають заряд і масу?
3. Ядро атома: а) має негативний заряд; 6) позитивний заряд; в) не має заряду.
4. Як визначити число протонів у ядрі атома: а) за порядковим номером елемента в Періодичній системі; б) за номером періоду; в) за номером групи?
5. Які характеристики атома вам відомі? Як їх можна визначити?
6. Дайте визначення поняттям «атом» і «хімічний елемент».
7. Наведіть сучасне формулювання Періодичного закону. Чим воно відрізняється від того, що ви вивчали раніше?
Завдання для засвоєння матеріалу
1. Ядро атома Гелію має заряд +2. Скільки електронів містить атом Гелію?
2. Атом Карбону містить 6 електронів. Чому дорівнює заряд: а) атома Карбону; 6) ядра атома Карбону?
3. Визначте число протонів в ядрах і заряди атомів: а) Літію; б) Сульфуру;
в) Феруму; г) Плюмбуму.
4. Визначте заряд ядра, число електронів та масу атома, якщо атомне ядро містить: а) 8 протонів і 9 нейтронів; 6) 25 протонів і ЗО нейтронів;
в) 89 протонів і 117 нейтронів. Назвіть відповідні хімічні елементи.
5. * Опишіть суть експерименту Резерфорда зі встановлення будови ато
ма. Які результати цього досліду дозволили йому зробити висновки про планетарну будову атома?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:47, Переглядів: 5872