Періодичний закон і електронна будова атомів
Матеріал параграфа допоможе вам:
• зрозуміти фізичну суть періодичного закону;
• виявити зв’язок між номером групи, у якій міститься елемент, і кількістю електронів на зовнішньому енергетичному рівні атома;
• пояснити зміну радіусів атомів елементів у періодах і підгрупах.
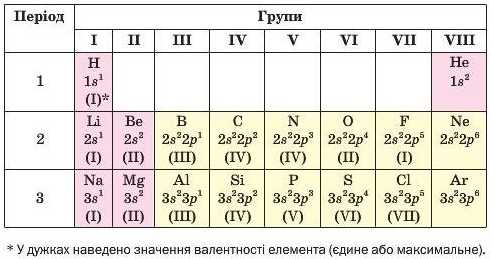
Мал. 21. Зовнішні енергетичні рівні атомів елементів перших трьох періодів
Фізична суть періодичного закону. Звернемо JiBary на заповнення електронами зовнішніх енергетичних рівнів атомів перших 18 елементів (мал. 21). Бачимо, що в природному ряду хімічних елементів кількість зовнішніх електронів в атомах та їх розміщення в орбіталях періодично повторюються. Наприклад, в атомах Гідрогену, Літію, Натрію на останньому' енергетичному рівні перебуває один s-електрон, в атомах Гелію, Берилію, Магнію — два s-електрони, в атомах Флуору, Хлору — два s-електрони і п’ять р-електронів.
За кількістю зовнішніх електронів можна передбачити хімічний характер елемента. В атомах елементів 2-го і 3-го періодів Літію, Берилію, Натрію, Магнію, Алюмінію на останньому енергетичному рівні перебуває невелика кількість електронів — від 1 до 3 (мал. 21). Це металічні елементи. В атомах неметалічних елементів кількість зовнішніх електронів більша — від 4 до 8.
Оскільки склад останнього енергетичного рівня атома впливає на хімічний характер елемента, то періодичність зміни електронної будови атомів елементів спричиняє періодичність зміни складу і властивостей речовин. У цьому полягає фізична суть періодичного закону.
Класифікація елементів за електронною будовою атомів. В основу однієї з класифікацій хімічних елементів покладено електронну будову атомів. Залежно від типу орбіталі, у якій перебувають електрони з найбільшою енергією, тобто зовнішні електрони, розрізняють s-елементи, р-еле.менти, d-елементи і f-елементи. Клітинки елементів у періодичній системі мають певний колір — рожевий (s-елементи), жовтий (p-елементи), синій (d-елементи), зелений (/-елементи).
s-Елементи (крім Гелію) належать до головних підгруп І та II груп, а р-елементи — до головних підгруп III—VIII груп. У побічних підгрупах містяться d-елементи, а /-елементи належать до побічної підгрупи III групи. Це — лантаноїди та актиноїди; їх винесено за межі основного поля періодичної системи.
Періодична система, електронна будова атомів і валентність елементів. Ви вже знаєте, що номер періоду', в якому розміщений елемент, указує на кількість енергетичних рівнів у його атомі. Згідно з інформацією, наведеною на малюнку 21, номер групи, у якій перебуває s- чи р-елемент, збігається з кількістю електронів на зовнішньому енергетичному рівні атома.
Оскільки валентність елементів залежить від електронної будови їх атомів, слід чекати на існування зв’язку між розміщенням елемента в періодичній системі і значенням його валентності. Цей зв’язок ілюструють такі закономірності: • максимальне значення валентності елемента збігається з номером групи, в якій він перебуває;
• значення валентності неметалічного елемента у сполуці з Гідрогеном або металічним елементом дорівнює різниці між числом 8 і номером групи, у якій розміщений неметалічний елемент;
• неметалічні елементи парних груп мають парні значення валентності, а неметалічні елементи непарних груп — непарні значення валентності.
Підтвердимо справедливість закономірностей на прикладі Сульфуру. Цей елемент міститься в VI групі періодичної системи й утворює сполуки, у яких виявляє парні значення валентності — 2, 4 і 6 (максимальне):
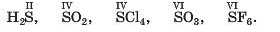
Існує кілька елементів, максимальні значення валентності яких відрізняються від номерів відповідних груп періодичної системи. Нітроген — елемент V групи, але максимальне значення його валентності дорівнює 4. Статі значення ватентності Оксигену (2) і Флуору (1) також не відповідають номерам груп (VI і VII). Чому це так, довідаєтесь на уроках хімії в старшій школі.
Зміна радіусів атомів елементів у періодах і підгрупах. Атом у нашій уяві є мікроскопічною кулькою з певним радіусом1.
Радіус атома — це відстань від центра ядра до сферичної поверхні, якої торкаються орбіта-лі з електронами останнього енергетичного рівня.
Радіуси атомів залежать від зарядів ядер і кількості енергетичних рівнів, на яких розміщені електрони.
Атоми елементів одного періоду мають однакову кількість енергетичних рівнів з електронами, але різні радіуси (мал. 20, 22). Заряди ядер атомів елементів у періоді зростають. Чим більший заряд ядра, тим ближче до нього перебувають електрони й тим.радіус атома менший.
1 Радіуси окремого атома і такого, який міститься в речовині, різні.


Таку залежність пояснює закон фізики, згідно з яким частинка з більшим зарядом сильніше притягує іншу, протилежно заряджену частинку.
Мал. 22. Відносні розміри атомів елементів 3-го періоду
Радіуси атомів елементів у періоді зменшуються зліва направо.
► Скориставшись малюнком 22, зіставте радіуси атомів металічних і неметалічних елементів 3-го періоду.
Тепер порівняємо атоми елементів однієї підгрупи. У них зі збільшенням порядкового номера елемента зростає кількість енергетичних рівнів, на яких розміщені електрони. Це приводить до збільшення розмірів атомів (мал. 23). Чим більше енергетичних рівнів має атом, тим його радіус більший.
Радіуси атомів елементів у підгрупі зростають зверху донизу.
Зверніть увагу на заряди ядер атомів Літію, Натрію і Калію. Вони різко зростають:+3 (Li), +11 (Na), +19 (К). Це має посилити притягання електронів до ядра і спричинити зменшення радіусів атомів. Однак зростаючі позитивні заряди ядер значною мірою екрануються (ніби нейтралізуються) негативними зарядами «внутрішніх» електронів. Кількість таких електронів від Літію до Калію збільшується майже так само, як і величина зарядів ядер. Тому визначальним чинником, який впливає на радіуси атомів елементів цієї та інших підгруп, є кількість енергетичних рівнів, на яких перебувають електрони.
Фізична суть періодичного закону полягає в тому, що зі зростанням зарядів ядер періодично змінюється електронна будова атомів, що зумовлює періодичні' зміну хімічного характеру елементів, їх валентності, властивостей простих речовин і сполук.
За електронною будовою атомів розрізняють S-, р-ч d-і /-елементи.
Номер групи, у якій міститься S-чи р-елемент, указує на кількість електронів на зовнішньому енергетичному рівні атома, а також на максимальне значення валентності елемента.
Радіуси атомів елементів у періоді зменшуються зліва направо, а в підгрупі зростають зверху донизу.
51. Поступово чи періодично змінюється зі зростанням порядкового номера елемента:
а) загальна кількість електронів в атомі;
б) кількість електронів на зовнішньому енергетичному рівні?
52. Випишіть у стовпчик усі символи елементів, що починаються з літери N. Після кожного символу вкажіть назву і тип відповідного елемента (S-, р-, d- чи f-елемент).
53. Не складаючи електронних формул, укажіть кількість електронів на останньому енергетичному рівні в атомах Cl, Pb, As, Kr.
54. Яку інформацію про хімічний елемент можна отримати з електронної формули атома?
55. Елементам яких типів належать такі електронні формули атомів:

56. Що таке радіус атома? Від яких чинників залежить його значення?
57. Атом якого елемента в кожній парі має більший радіус: Si-R F-Br, Н—Не, Na—Ве? Відповіді поясніть.
58. З’ясувавши, як змінюються радіуси атомів у рядках елементів Be-Mg-Al і Be-В—Al, оберіть правильну відповідь:
а) радіус атома Берилію більший, ніж атома Алюмінію;
б) радіус атома Алюмінію більший, ніж атома Берилію;
в) радіуси атомів Берилію та Алюмінію майже однакові.
59. Назвіть елемент, атом якого, на вашу думку, має: а) найменший радіус; б) найбільший радіус. Поясніть ваш вибір.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:43, Переглядів: 3713