§ 6. Періодичний закон Д. І. Менделєєва

Опрацювавши зміст параграфа, ви будете:
• мати уявлення про відкриття Періодичного закону;
• знати менделєєвське формулювання Періодичного закону;
• розуміти суть такої закономірності, як періодичність;
• вміти пояснювати періодичність зміни властивостей хімічних елементів.
Ви вже знаєте, що вчені за часів Д. І. Менделєєва, намагаючись класифікувати відомі хімічні елементи, поділяли їх на родини. Було відомо 6 груп подібних за властивостями елементів: лужні елеліенти, лужноземельні елементи, галогени, група Оксигену, група Нітрогену і група Карбону. Знайдіть зазначені групи за Періодичною системою.
Але згрупувати всі відомі на той час 63 хімічні елементи не вдавалося. Знання про них були уривчасті. У той час вчені вважали, що природні групи елементів, особливо протилежні за властивостями, ніяк між собою не пов’язані.
І хоча вони звертали увагу на зв'язок властивостей речовин з відносною атомною масою елемента, що утворює цю речовину, їм не вдалося об’єднати всі елементи в єдину систему. Спираючись на праці своїх попередників, це завдання розв’язав великий російський учений Д. І. Менделєєв.
На відмін)' від інших учених Д. І. Менделєєв був глибоко переконаний, що між усіма хімічними елементами, як подібними за властивостями, так і відмінними, повинен існувати природний загальний зв'язок, який об’єднував би всі елементи в єдину систему.
За основу систематизації хімічних елементів Д. І. Менделєєв (так само, як і раніше Ю. Л. Мєйєр) обрав відносну атомну масу, вважаючи її головною характеристикою елемента, оскільки вона не змінюється під час утворення елементом простих і складних речовин. Д. І. Менделєєв не розглядав масу як єдину характеристику елемента. Він надавав величезного значення ще і його хімічним властивостям.
Згрупувавши більшість відомих тоді хімічних елементів у кілька горизонтальних рядів так, щоб вертикальні стовпчики містили елементи, подібні за хімічними властивостями, Д. L Менделєєв у 1869 р. розробив Періодичну систему у формі таблиці - прообраз сучасної Періодичної системи хімічних елементів. А далі добудовував і доповнював цю первісну таблицю, доки не включив до неї всі відомі на той час 63 елементи. Один із останніх варіантів Періодичної системи, створеної Д. І. Менделєєвим, за формою мало чим відрізняється від відомої нам Періодичної системи (див. форзац).
• Розгляньте фрагмент Періодичної системи (табл. 3) і зробіть висновок, як у порядку зростання відносних атомних мас елементів змінюються:
а) властивості елементів; 6) властивості простих і складних речовин, утворених елементами; в) валентність елементів (у сполуках з Оксигеном).
Таблиця З
Зміна властивостей хімічних елементів
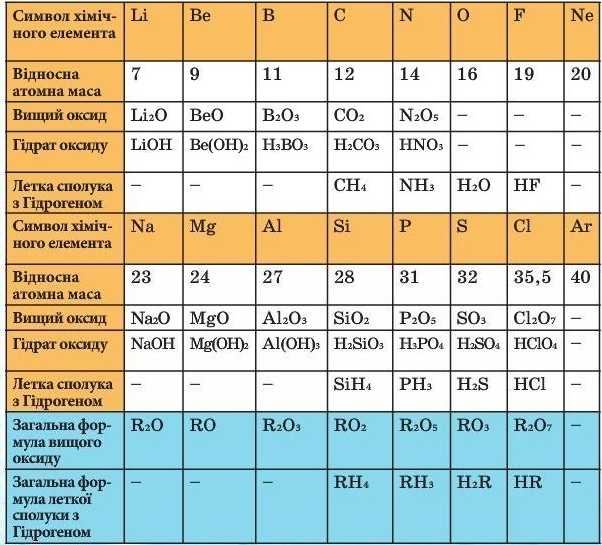
Вивчаючи зміну властивостей елементів, розміщених у ряд ВІДПОВІДНО зростання їх відносних атомних мас, Д.І. Менделєєв виявив повторення однакових ознак у хімічних елементів і назвав цю закономірність періодичністю. Виявлену закономірність він сформулював у вигляді Періодичного закону, суть якого оприлюднив у 1869 р.:
Властивості елементів, а тому і властивості утворених ними простих і складних речовин перебувають у періодичній залежності від величини атомних мас елементів.
Висновки
Періодичний закон відкрив російський учений Д. І. Менделєєв у 1869 р. Його суть за Д. І. Менделєєвим, полягає в тому, що властивості хімічних елементів та їх сполук перебувають у періодичній залежності від атомної маси елементів.
Це матеріал з підручника Хімія 8 клас Буринська
Автор: admin от 18-10-2016, 22:10, Переглядів: 1602