§ 7. Будова атома. склад атомних ядер
Опанувавши матеріал параграфа, ви зможете:
• знати будову атомів, склад атомних ядер; сучасне трактування періодичного закону;
• розрізняти поняття «протони», «нейтрони», «електрони», «нуклони», «нукліди»;
• пояснювати фізичний зміст порядкового номера елемента;
• уміти визначати будову атома, заряд його ядра, користуючись періодичною системою хімічних елементів.
З'ясуйте, що вам відомо про будову атомів хімічних елементів з попередніх класів.

Ядро й електронна оболонка. Під час вивчення поняття «хімічний елемент», ви вже частково ознайомилися з будовою атома. Вам відомо, що першоїючаткова назва «атом», яка в перекладі означає «неподільний», на сьогоднішній день умовною. Дійсно, цю частинку тривалий час вважали неподільною. Однак неподільність атома заперечили наукові дослідження французького фізика Лнрі Беккереля, якому належить відкриття явища радіоактивності (1896 р.). Це відкриття слугувало основою для підтвердження складності будови атома англійському фізику Epnecmy Резерфорду. Досліджуючи природу радіоактивного випромінювання, у 1911 р. вчений запропонував ядерну (планетарії)') модель будови атома. Складовими частинами атома є ядро й електронна оболонка. Ядро, що має позитивний заряд, знаходиться в центрі атома, а навколо нього на певних віддалях (орбітах) обертаються негативно заряджені електрони (рис. 9).
Ураховуючи те, іцо атом є електронейтральпою частинкою, позитивний заряд ядра компенсується відповідною кількістю електронів.
Склад атомних ядер. Відкриття будови атома дало поштовх до нодальні их досліджені» його будови. Через кіл ька років Е. Резерфорд виявив, що й ядро атома є складним утворенням. У ядрі містяться позитивно заряджені частинки протони р, що мають заряд +1. Інший англійський учений Джеймс Чедвік експериментально виявив і нейтральну частинку ядра та дав їй назву нейтрон п.
Установлено: маса нейтрона така сама, як маса протона.
Оскільки протони є позитивно зарядженими частинками із зарядом +1, а нейтрони — електронейтральними, то заряд ядра атома визначається числом протонів у ядрі. В атома Карбону заряд ядра +6, а в Оксисену +8. Отже, заряд ядра атома відповідає порядковому номеру елемента в періодичній системі. У цьому полягає фізичний зміст порядкового номера елемента. Враховуючи те, що порядковий номер елемента вказує на заряд ядра атома, учені сформулювали сучасне трактування періодичного закону.
Властивості хімічних елементів і їх сполук перебувають у періодичній залежності від величини зарядів їх атомних ядер.
Загальна назва протонів і нейтронів у ядрі атома нуклон. Отже, ядра атомів це система нуклонів (А), що взаємопов’язана між собою ядерною силою.
Від кількості нуклонів, які містяться в ядрі, залежить утворення різних видів атомних ядер нуклідів. Нуклід характеризується певної» кількістю прогонів (Z) і нейтронів (N).
Спрощено будову ядра атома Карбону подано па рисунку 10.

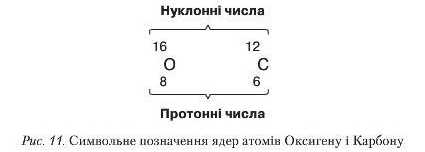
Загальну кількість протонів і нейтронів у ядрі навивають нуклопним числом.
Кількість протонів у ядрі визначається протонним числом. Ураховуючи те, що основою атома є ядро, його позначають символом елемента, біля якого вгорі зліва проставляють нуклонне, а внизу зліва — протонне числа (рис. 11).
Вам уже відомо, що атом електронейтральна частинка. Тому позитивний заряд ядра атома компенсується негативно зарядженими електронами, які безперервно рухаються навколо ядра. Науковцями виявлено, що електрони рухаються не безладно, а па певній віддалі від ядра, яка зумовлюється запасом їх енергії.
Віддалі, па яких рухаються електрони відносно ядра атома, називають енергетичними ріинями. Певна кількість енергетичних рівнів утворює електронну оболонку атома.
Отже, ураховуючи будову атомів хімічних елементів, можна зробити подані нижче висновки.
1. Атом є складною системою, яка складається з ядра та електронної оболонки.
2. Ядро атома вміщує певну кількість нуклонів, що дорівнює сумі протонів (Z) і нейтронів (N).
3. Вид атомів одного хімічного елемента з певним числом протонів і нейтронів називають нуклідом.
4. Навколо ядра атома рухаються електрони, кількість яких відповідає величині заряду ядра. Сукупність усіх електронів утворює електронну оболонку атома.
5. Електрони в електронній оболонці знаходяться на певних віддалях від ядра, так званих енергетичних рівнях.
Ізотопи. Якщо ви звернули увагу па значення відносних атомних мас елементів у періодичній системі, то побачили, що вони виражені дробовими, а не цілими числами. «Як це пояснити? — запитаєте ви. Адже ми з’ясували, що нуклонне число відповідає сумі протонів і нейтронів, маса кожного з яких дорівнює 1».
Ученими доведено, що більшість елементів складаються не з одного, а з кількох нуклідів. Наприклад, у природі трапляються по три різновиди атомів Гідрогену, Оксигепу, Карбону, два різновиди атомів Хлору тощо. Вони характеризуються однаковими зарядами ядра атома, але різними иуклоппими числами. Суть цього явища полягає в тому, що до складу атомних ядер може входити різна кількість нейтронів. Наприклад, Гідроген утворює різновиди атомів з иуклоппими числами 1, 2, 3, які дістали, відповідно, назви Протій j Н, Дейтерій jH (D), Тритій j H (Т). Із наведених позначень видно, що в Протію у ядрі атома є лише 1 протон, у Дейтерію 1 протон і 1 нейтрон, а в Тритію 1 протон і 2 нейтрони.
Різновиди атомів одного й того самого хімічного елемента, що мають однаковий заряд ядра (протонне число), але різні ііуклонпі числа, пазиваіоть ізотопами.
Існуванням ізотонів і пояснюються дробові значення відносних атомних мас, оскільки їх обчислюють з урахуванням масової частки кожного нукліда в природі. Наприклад, у Хлорі масова частка легкого ізотону ?*'С1 становить приблизно 75,53 %, а важкого iiiCI 24,47 %. Звідси округлено відносна атомна маса Хлору дорівнює 35,5. А з огляду на те, що елементи з однаковим зарядом ядра проявляють однакові властивості, ізотопний склад під час їх вивчення не беруть до уваги.
Ураховуючи факт існування ізотопів, було уточнено визначення поняття «хімічний елемент».
Хімічний елемент це вид атомів з однаковим зарядом ядра.
Існують два види ізотонів, класифіковані за здатністю до випромінювання, а саме: стабільні та радіоактивні.
' ЦІКАВО НИМ И
• Стабільні ізотопинаявні у більшості хімічних елементів. Радіоактивні ізотопихарактеризуються тим, що вони проявляють здатність самовільно розкладатися на атоми (нукліди) інших елементів, вивільняючи при цьому радіоактивне випромінювання, що має велику проникну здатність і згубно впливає на живі організми. Проникаючи всередину організму, воно викликає патогенні зміни, що передаються генетично з покоління в покоління. Навіть невисокі, але довготривалі дози радіоактивного випромінювання, викликають різні захворювання: пневмонію, анемію, діабет, порушують роботу імунної системи тощо. Кожна культурна людина має знати, як можна зменшити вплив радіації на організм. Для цього необхідно дотримуватися особистої гігієни; споживати якісні, не забруднені радіонуклідами продукти харчування й воду, дбати про чистоту одягу, взуття, приміщень. Особливо треба берегтись у зонах підвищеної радіації та ретельно дотримуватися порад спеціалістів щодо збереження здоров’я у цих складних умовах.
Визначення будови атома за періодичною системою. Будову атомів хімічних елементів дуже зручно визначати, користуючись періодичною системою. Кількість протонів визначається за протонним числом (у Д. І. Менделєєва порядковий помер елемента). Якщо від числового значення відносної атомної маси елемента, що теж внесена у періодичну систему, відняти число протонів, то отримана різниця відповідає кількості нейтронів у ядрі атома. Число електронів в електронній оболонці відповідає числу протонів.
ПІДСУМОВУЄМО ВИВ НЕПЕ
• Дослідження радіоактивного випромінювання змінили усталену думку вчених про неподільність атома. Е. Резерфорд установив, що атом складається з позитивно зарядженого ядра й електронної оболонки, яка компенсує заряд ядра, а тому атом є електронейтральною частинкою.
• До складу ядра атома входять протони — позитивно заряджені частинки з зарядом +1 та масою 1 і нейтрони — електроней-тральні частинки з масою 1. Загальна назва протонів і нейтронів у ядрі — нуклон. Від кількості нуклонів у ядрі залежить утворення різних видів атомних ядер — нуклідів.
• Заряд ядра атома визначається числом протонів у ядрі, протонним числом, що відповідає порядковому номеру елемента. У цьому полягає фізична суть порядкового номера елемента.
• Різновиди атомів одного й того хімічного елемента, що мають однаковий заряд ядра (протонне число), але різні нуклонні числа, називають ізотопами.
• Хімічний елемент —- це вид атомів з однаковим зарядом ядра (протонним числом).
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Назвіть складові частинки атомів хімічних елементів.
2. Сформулюйте визначення періодичного закону:
а) у трактуванні Д. І. Менделєєва;
б) у сучасному трактуванні з погляду будови атома.
3. Нарисуйте в зошиті ядерну модель будови атома Нітрогену та вкажіть його складові.
4. Назвіть частинки, що входять до складу ядра атома, опишіть його будову.
5. Поясніть фізичну суть порядкового номера елемента в періодичній системі.
6. Обґрунтуйте, чому в періодичній системі відносні атомні маси виражені дробовими числами.
7. Позначте, користуючись періодичною системою, числове значення протонного числа в атомі Фосфору:
АЗО; Б 15; В 16; Г31.
8. Охарактеризуйте, користуючись періодичною системою, будову атома елемента з порядковим номером 20.
1ЦІКАВО ЗНАТИ
Опромінення насіння злакових культур сприяло виведенню великої кількості сортів, що є стійкими до захворювань. Для них притаманні такі властивості, як висока якість зерна, раннє його достигання, міцні стебла рослин, підвищена врожайність.
• Середні індивідуальні дози опромінення населення становлять від 5 до 10 бер. У 1,5 млн людей, за даними Всесвітньої організації охорони зоров’я, дози опромінення щитоподібної залози становлять до ЗО бер, що набагато перевищує допустимі норми.
За участю радіоактивних ізотопів ученими розроблено метод «мічених атомів». У хімії за його допомогою з’ясовують механізми перебігу хімічних реакцій. У медицині — для встановлення правильного діагнозу та з лікувальними цілями. В техніці — для виявлення тріщин у недоступних місцях різних приладів.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:46, Переглядів: 3312