§ 22. Фізичні й хімічні властивості оксидів
— Чи знаєш ти, який із оксидів для нас є особливо дорогим? Без нього неможливе життя на Землі.
— Це гідроген оксид — вода.
— Так. Нас оточує безліч оксидів. Ознайомимося з ними ближче.
З яких елементів складаються оксиди, ми вже знаємо — будь-який елемент й Оксиген. Ми знаємо як складати формули цих сполук.
Нагадаємо ще і те, що в Оксигену в оксидах ступінь окиснення завжди -2. Зараз розглянемо їхні фізичні й хімічні властивості.
ФІЗИЧНІ ВЛАСТИВОСТІ ОКСИДІВ

Фізичні властивості оксидів дуже різноманітні. Густини, температури плавлення й кипіння змінюються в широких межах.
Оксиди лужних, лужноземельних і деяких інших металів (Al, Zn, Ті) мають білий колір, інші оксиди забарвлені в різні кольори.
За звичайних умов оксиди можуть перебувати в різних агрегатних станах. Наприклад, майже всі основні й амфотерні оксиди — тверді речовини. У них, в основному, йонна кристалічна ґратка.
Кислотні оксиди можуть бути твердими речовинами — P2O5, SiO2, рідинами — N2O3, H2O, багато з них є газами— CO2, NO2, SO2. Найчастіше в цих оксидів молекулярна ґратка, хоча є оксиди й з атомною ґраткою, наприклад SiO2.
Твердий CO2 називають ще «сухий лід», тому що він із твердого стану переходить відразу в газоподібний стан, минаючи рідкий. При цьому утворюється густий білий дим.

ХІМІЧНІ ВЛАСТИВОСТІ ОКСИДІВ
Хіміків насамперед цікавлять, звичайно ж, хімічні властивості оксидів. Вони досить різноманітні, але можна виділити й загальні властивості.
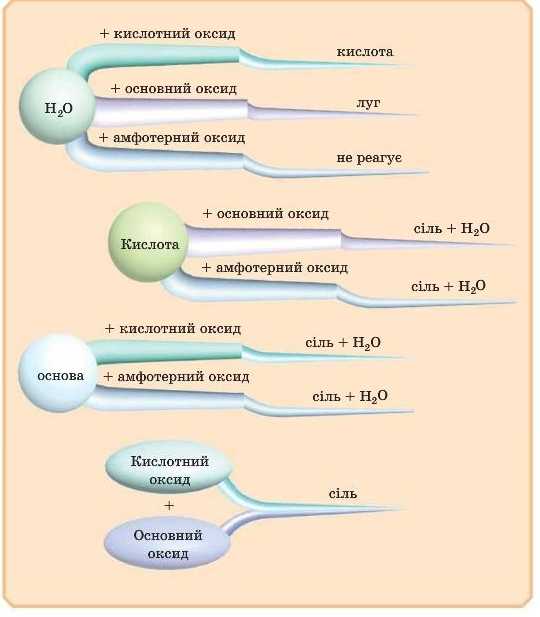
1. Взаємодія з водою
З водою реагують як кислотні, так і основні оксиди. Амфотерні оксиди з водою не взаємодіють. Це дуже важлива реакція — так одержують деякі кислоти й основи, причому кислоти утворюються з кислотних оксидів, а основи — з основних.
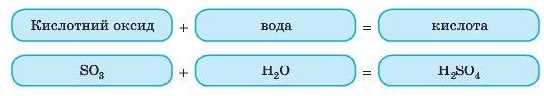
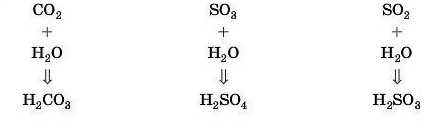
Це реакція сполучення. У найпростіших випадках формулу кислоти, що утворюється, легко одержати з формули кислотного оксиду простим додаванням. Наприклад:
З іншими оксидами не так усе просто. Це оксиди, наприклад, VA підгрупи:
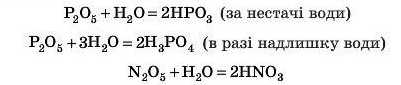
ДІЗНАЙТЕСЯ БІЛЬШЕ

Хоча й у цих випадках можна міркувати так само:
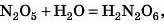
а тепер, скоротивши всі індекси на 2, одержимо HNO3.
Кислуватий смак газованої води пояснюється утворенням карбонатної кислоти H2CO3 внаслідок узаємодії кислотного оксиду CO2 з водою:
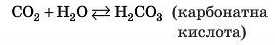
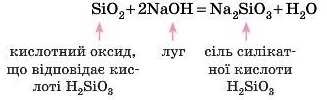
Не всі кислотні оксиди реагують із водою. Так, силщій(ІУ) оксид SiO2 з водою не реагує.
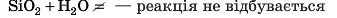
SiO2 — основна складова частина піску, а ви добре знаєте, що пісок із водою не реагує (рис. 46).

Однак SiO2 можна одержати з кислоти H2SiO3, віднімаючи воду'.
H2SiO3 —> SiO2 + H2O
Тому говорять, що кислотним оксидам відповідають кислоти, маючи при цьому на увазі, що можна одержати певну кислоту з оксиду або, навпаки, відповідний оксид із кислоти. У будь-якому разі кислотному оксиду завжди відповідає певна кислота:
502 (сульфур(ІУ) оксид) — H2SO3 (сульфітна кислота);
503 (сульфур(УІ) оксид) — H2SO4 (сульфатна кислота);
SiO2 (силіцій(ГУ) оксид) — H2SiO3 (силікатна кислота).
Ф Важливо! Ступені окиснення неметалічного елемента в оксиді й відповідній йому кислоті однакові!
ДІЗНАЙТЕСЯ БІЛЬШЕ
Із цього правила є винятки, наприклад, унаслідок узаємодїї кислотного оксиду з водою можуть утворитися навіть дві різні кислоти:
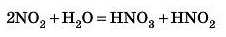
Детальніше ви будете вивчати такі реакції в старших класах.
Завдання. Установіть відповідність між оксидом і кислотою.

Підказка: визначте ступені окиснення. В оксиді й відповідній йому кислоті вони однакові.
Перейдемо до основних оксидів.
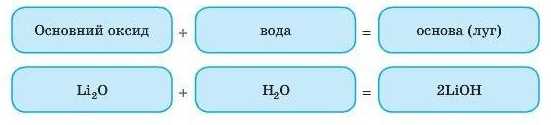
Із водою реагують тільки основні оксиди, утворені лужними (ІА підгрупа) і лужноземельними металами (ІІА підгрупа — Ca, Sr, Ba). При цьому виділяється велика кількість тепла. Оксиди Кальцію, Стронцію й Барію реагують із водою за звичайних умов, а магній оксид реагує з водою тільки за тривалого кип’ятіння.
Є й інші оксиди металів, які реагують із водою, але їх вивчення не входить у рамки шкільної програми.
— А я знаю, як зварити яйця, не використовуючи вогню!
— І я знаю! На електроплиті. — Та ні, з допомогою енергії хімічної реакції!
— Ну, і як?
— Треба обкласти яйце шматочками кальцій оксиду CaO (його ще називають негашеним вапном) і полити водою! Відбувається хімічна реакція з виділенням великої кількості тепла. Цього досить, щоби зварити яйце, точніше спекти.

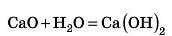
Але треба бути дуже обережним(!). У результаті реакції утворюється сильний луг — кальцій гідроксид, який може ушкодити шкіру рук. Ви можете повторити цей дослід у шкільній лабораторії.
Існує, однак, велика кількість основних оксидів, які не реагують із водою.
CuO+ H2O= реакція не відбувається
Як ще можна дізнатися, чи реагують оксиди з водою? Можна скористатися таблицею розчинності й подивитися, чи буде гідроксид, який ми маємо намір одержати, розчинним. Якщо «так» (у клітинці літера «Р»), то оксид із водою взаємодіє, якщо «ні» (у клітинці літера «Н») — взаємодія оксиду з водою неможлива.
Завдання. Визначте, чи реагуватимуть із водою барій оксид, оксиди Феруму(ІІ) і (III), нікол(ІІ) оксид, силіцій(ІУ) оксид?
Кожному основному оксиду відповідає певна основа:
• MgO (магній оксид) — Mg(OH)2 (магній гідроксид);
• Cr2O3 (хром(ІІІ) оксид) — Cr(OH)3 (хром(ІІІ) гідроксид);
• Na2O (натрій оксид) — NaOH (натрій гідроксид).
Тут слово «відповідає» означає те саме, що й у кислотних оксидах: або із цього оксиду можна одержати основу внаслідок узаємо-дії з водою, або оксид можна одержати з відповідної основи під час відщеплення води (розкладу під час нагрівання).
Завдання. Установіть відповідності.

Підказка: визначте ступені окиснення. В оксиді й відповідній йому основі вони однакові.
Важливо! Ступені окиснення металічного елемента в оксиді й відповідному йому гідроксиді однакові.
2. Взаємодія кислотних оксидів з основними
Всі кислотні оксиди реагують із основними оксидами. При цьому утворюється сіль. Це реакція сполучення.

Для того щоби правильно написати такі рівняння, треба діяти поетапно:
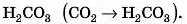
1) Зрозуміти, яка кислота відповідає кислотному оксиду. У цьому випадку це карбонатна кислота
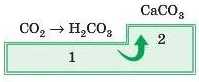
2) Потім, згадавши, що солі складаються з атомів металу й кислотного залишку, записати формулу солі: метал, зрозуміло, буде такий, як в основному оксиді, а кислотний залишок — як у відповідній кислотному оксиду кислоті.
Можна навіть підписати формулу кислоти під формулою кислотного оксиду, ось таї::
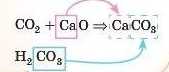
Завдання. Закінчіть рівняння реакцій:
MgO+ SiO2 =
BaO+ SO3 =
CuO + SO2 = Відповідь 1дивіться наприкінці параграфа.
3. Взаємодія кислотних оксидів із лугами
Всі кислотні оксиди реагують із лугами. При цьому утворюються сіль і вода. Це реакція обміну.
~
Реакції, в яких реагенти обмінюються катіонами (або аніонами), називають реакціями обміну:
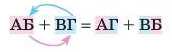
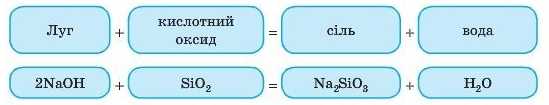
Під час складання таких рівнянь слід також спочатку подумати, яка кислота відповідає оксиду:
Завдання. Закінчіть рівняння реакцій:
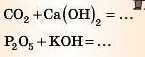
Відповідь 2 дивіться наприкінці параграфа.
Оскільки реакція з основами є загальною для всіх кислотних оксидів, їм можна дати таке визначення:
Оксиди, які взаємодіють з основами з утворенням солі й води, називають кислотними оксидами.
4. Взаємодія основних оксидів із кислотами
Всі основні оксиди реагують із кислотами. При цьому утворюються сіль і вода. Це реакція обміну.
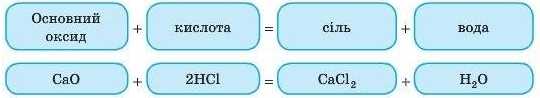
Завдання. Напишіть рівняння реакцій між такими речовинами:
1) сульфатною кислотою й купрум(П) оксидом;
2) нітратною кислотою й ферум(ІІІ) оксидом.
Відповідь3 дивіться наприкінці параграфа.
Дослід
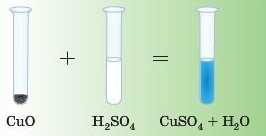
Якщо до чорного порошку KjmpyM(II) оксиду додати розчин сульфатної кислоти, порошок розчиниться й утвориться розчин блакитного кольору. Такий колір у всіх розчинів солей двовалентного Купруму.
Таким чином, загальна властивість основних оксидів полягає в здатності реагувати з кислотами з утворенням солі й води. Дамо їм інше визначення:
Оксиди, які взаємодіють із кислотами з утворенням солі й води та яким відповідають основи, називають основними оксидами.
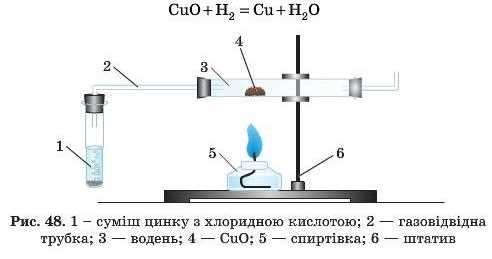
5. Взаємодія з воднем
Внаслідок узаємодії оксидів металів з воднем утворюються метали й вода. Так одержують чисті метали в лабораторії та промисловості.
ХІМІЧНІ ВЛАСТИВОСТІ АМФОТЕРНИХ ОКСИДІВ
Амфотерні оксиди — це оксиди, які залежно від умов можуть проявляти як кислотні, так і основні властивості. Отже, їх характеризують реакції взаємодії як із кислотами, так і з основами (лугами).
З водою амфотерні оксиди не реагують.
1. Взаємодія з кислотами
Реакція відбувається так само, як і з основними оксидами.

2. Взаємодія з лугами
Ця реакція може відбуватися по-різному залежно від умов. Якщо реакція відбувається між речовинами в розплавленому стані:
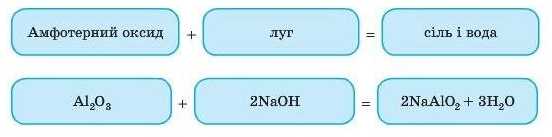
Пояснення може бути таким: у цій реакції Al2O3 є кислотним оксидом. Міркування такі самі, як і під час запису реакції кислотних оксидів з основами. Тому запишемо під формулою оксиду відповідний йому гідроксид: Al(OH)3. Зараз він виглядає як основа. Запишемо інакше: H3AlO3 — тепер цей гідроксид виглядає як кислота.
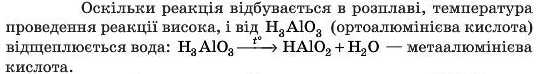
Закінчуємо рівняння реакції виходячи з того, що з NaOH реагує HAlO2 з утворенням солі NaAlO2.
Реакція між речовинами в розчині відбувається так:
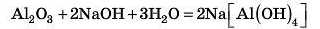
У результаті реакції утворюється складна комплексна сіль — натрій тетрагідроксоалюмінат. Такі складні солі ми будемо вивчати пізніше.
Цікаво, що деякі амфотерні оксиди можуть витискувати залишки слабких і нестійких кислот із їх солей:
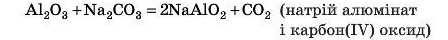
Також менш леткі оксиди витісняють із солей більш леткі. Наприклад, SiO2 (пісок), очевидно, зовсім нелеткий, a CO2 (вуглекислий газ) — звичайно ж, леткий, він же газ! Тому можлива реакція:
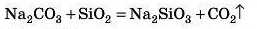
Оксиди Алюмінію й Цинку взаємодіють також з кислотними оксидами:
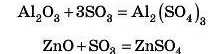
та основними оксидами: а) під час сплавлення:
б) в розчині:
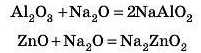
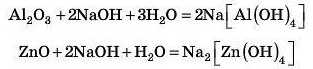
Робимо висновки:
ВІДПОВІДІ ДО ЗАВДАНЬ ПАРАГРАФА
Відповідь 1
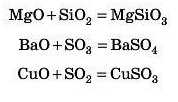
Відповідь 2
Відповідь З
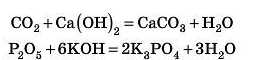
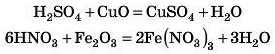
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Назвіть хімічні властивості основних оксидів; кислотних оксидів.
2. У чому особливість хімічних властивостей амфотерних оксидів?
3. Виберіть помилкове твердження:
а) у складі оксидів є атоми Оксигену;
б) у реакції з водою кислотний оксид SO2 утворює кислоту;
в) оксид — складна речовина, загальна формула якого EvHy, де E — атоми елемента, a H — атоми Гідрогену;
г) основні оксиди утворені тільки металічними елементами.
4. Кожний ряд оксидів доповніть формулою речовини, подібної до наведених за хімічними властивостями:
а) CO2, SO2,...;
б) Na2O, CaO, ...;
в) Al2O3, Cr2O3,...
ВИКОНАЙТЕ ЗАВДАННЯ
1.3 якими речовинами, формули яких наведено в другому стовпчику, необхідно провести хімічні реакцій, щоб з’ясувати кислотно-основний характер кожного з оксидів першого стовпчика?

Запишіть ці рівняння реакцій.
2. Укажіть правильну схему реакції:
а) оксид неметалу + вода —» основа;
б) метан + кисень —» основний оксид;
в) неметач + кисень —> основний оксид;
г) основний оксид + кислотний оксид —» кислота. Запишіть рівняння реакції.
3. Амфотерний оксид — це складна речовина, яка проявляє такі властивості:
а) кислотні;
б) основні;
в) кислотні й основні;
г) правильної відповіді немає.
4. Закінчіть рівняння можливих реакцій:
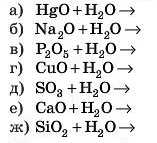
Підказка: не забудьте, що деякі реакції неможливі!
δ. Напишіть формули вищих оксидів елементів третього періоду. Які властивості вони проявлятимуть?
Підтвердьте свою відповідь рівняннями реакцій.
6. Сульфур(УІ) оксид узаємодіє з кожною з двох речовин:
1) вода й хлоридна кислота;
2) кисень і магній оксид;
3) кальцій оксид і натрій гідроксид;
4) вода й мідь.
7. На повне відновлення міді з купрум(ІІ) оксиду витрачено 3,5 моль водню (н. у.).
Яка маса міді утворилася?
8. Скільки молів води необхідно для повного розчинення 0,25 моль натрій оксиду?
Обчисліть масу отриманого нри цьому гідроксиду.
9. Необхідно одержати 2 моль сульфатної кислоти. Обчисліть масу води й число молів відповідного оксиду, які мають прореагувати.
10. Які з наведених речовин можна використовувати для поглинання вуглекислого газу з повітря:
✓ розчин натрій гідроксиду,
✓ розчин сульфатної кислоти,
✓ фосфор(У) оксид,
✓ вапнякова вода Ca(OH)2,
✓ кальцій оксид?
Напишіть відповідні рівняння реакцій.
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:12, Переглядів: 3169