§ 24. Фізичні та хімічні властивості оксидів
Опанувавши матеріал параграфа, ви зможете:
• формулювати визначення основних, кислотних, амфотерних оксидів;
• характеризувати фізичні властивості оксидів; хімічні властивості основних, кислотних, амфотерних оксидів;
поняття амфотерності;
• порівнювати хімічні властивості основних, кислотних, амфотерних оксидів;
• складати рівняння реакцій, що характеризують хімічні властивості основних, кислотних та амфотерних оксидів;
• формувати бережливе ставлення до води як оксида, що забезпечує життєдіяльність живих організмів; ініціативність і підприємливість щодо збереження водних ресурсів; павички безпечного поводження з оксидами, які спричиняють шкоду людині, сільському господарству, виробництвам.
Пригадайте назви оксидів, що утворюються в атмосфері внаслідок господарської діяльності людини.
Що вам відомо про найпоширеніший на Землі оксид — воду?
Фізичні властивості оксидів. Оксиди як сполуки елементів з Оксигеном досить поширені в природі. За нормальних умов вони перебувають у різних агрегатних станах: газоподібному, рідкому, твердому. Наведемо приклади. Поширені в природі й унаслідок господарської діяльності людини вуглекислий газ (карбои(ГУ) оксид), сульфур(ІУ) оксид, нітроген(IV) оксид є газами. Як вам відомо, великі концентрації цих газів у атмосфері спричиняють утворення кислотних дощів. Силіцій(ІУ) оксид, фосфор(У) оксид, магній оксид та інші тверді речовини безбарвні або мають характерне забарвлення. Наприклад: хром(ІІІ) оксид зелений, магній оксид — білий, ферум(ІП) оксид і Iirrporeii(IV) оксид бурого кольору, а силіцій(ІУ) оксид безбарвний. Розглянувши зразки оксидів, ви наочно пе]>еконаєтеся в цьому.
Для багатьох оксидів притаманний характерний запах. Наприклад, сульфур(ІУ) оксид, IiiTporeii(IV) оксид — задушливі гази; карбоп(ІІ) оксид, карбоп(ІУ) оксид без запаху, отруйні.
У твердому стані оксиди утворюють атомні, йошіі або молекулярні структури (кристалічні ґратки). До оксидів із молекулярними кристалічними ґратками належить вода (рис. 32, с. 88), кар-боп(ІУ) оксид. Атомну кристалічну ґратку має силіцій(ІУ) оксид, йонну алюміній оксид.
Оксиди з атомними структурами характеризуються високою твердістю, з молекулярними леткістю. Температури плавлення й кипіння змінюються в широкому діапазоні.
Напишіть самостійно формули всіх згаданих у тексті оксидів.
Хімічні властивості основних оксидів. Оскільки оксиди є сполуками елементів з Оксигеном, то їм властиві як спільні, так і
відмінні властивості. Виходячи а паяв цих груп оксидів, їм можна дати визначення.
Основні оксиди це оксиди, яким відповідають основи.
Наприклад, натрій оксиду Na2O відповідає основа натрій гід-роксид NaOH1 кальцій оксиду CaO - кальцій гідроксид Ca(OH)2.
Основні оксиди вступають у хімічну взаємодію а водою, кислотами й кислотними оксидами.
Пригадайте реакцію сполученя кальцій оксиду з водою, напишіть рівняння реакції.
Дослідимо хімічні властивості основних оксидів аа допомогою експерименту.
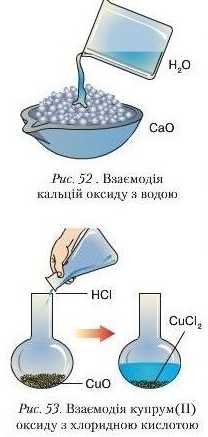
1. Взаємодія з водою.
Дослід I. Oкрім кал ь і іі й оксиду (рис. 52), а водою реагують оксиди лужних і лужноземельних металічних елементів (SrO, BaO). Наприклад:
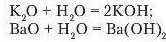
Продуктами цих реакцій, відповідно, є основи калій та барій гідроксиди. Обидва гідроксиди добре розчинні у воді.
Як називають розчинні у воді основи?
2. Взаємодія з кислотами.
Д о с л ід 2. Насиплемо в колбу кунрум(ІІ) оксиду (чорний порошок) і доллємо хлоридпої кислоти. Під час нагрівання утворюється прозора рідина блакитного кольору. Під час перебігу реакції зменшується вміст купрум(ІІ) оксиду (рис. 53).
Пригадайте, які ознаки перебігу хімічних реакцій вам відомі.
У розчині є сіль купрум(ІІ) хлорид, яка забарвлює його в блакитний колір.
3. Взаємодія з кислотними оксидами.
Цікавим прикладом взаємодії оксидів між собою є реакції, що лежать в основі виробництва скла. Унаслідок взаємодії кальцій і силіцій(ЇУ) оксидів за нагрівання утворюється сіль — кальцій силікат:
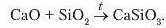
У промисловості виробляють різні види скла сплавлянням оксидів. Віконне скло має хімічний склад Na2O · CaO · GSi2O.
Хімічні властивості кислотних оксидів. Одну з властивостей кислотних оксидів ви вже знаєте. Це взаємодія з основними оксидами. Окрім цього, вони реагують з водою й основами. Доведемо це експериментально.
1. Взаємодія з водою.
Вуглекислий газ, який пропускають під тиском крізь воду, частково взємодіє з нею. Під час такої взаємодії утворюється гідроксид, що проявляє кислотні властивості, карбонатна кислота. Це дуже слабка кислота, тому вона має здатність розпадатися до вихідних речовин.
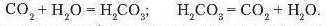
Розщеплення кароонатної кислоти до вихідних речовин можна спостерігати, якщо відкрити пляшку з газованою водою.
Однак не всі кислотні оксиди з водою утворюють нестійкі кислоти. За взаємодії сульфур(УІ) оксиду з водою утворюється стійка сульфатна кислота:
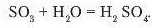
Напишіть самостійно рівняння реакції взаємодії фосфор(У) оксиду з водою. Назвіть тип цих реакцій і сформулюйте їх визначення.
Взаємодія кислотних оксидів, які викидаються в атмосферу під час хімічних виробництв, з водою призводить до утворення кислотних дощів. Вам уже відомо, що кислотні дощі негативно
впливають на рослинний і тваринний світ. Окрім цього, підвищується кислотніть ґрунтів» що веде до зниження врожайності й якості сільськогосподарських культур. Підвищення концентрації кислот у воді річок та озер спричиняє вимирання водних тварин. Необхідно додати, що кислотні дощі роз’їдають металеві покриття будинків, фарби, руйнують пам’ятки архітектури та культури.
Запропонуйте заходи боротьби з кислотними дощами.
Треба звернути увагу пате, що не всі кислотні оксиди реагують з водою.
Вам відомо, що береги багатьох річок, озер, морів укриті силіцій(ІУ) оксидом (піском), який безпосередньо стикається з водою, та реакція не відбувається. Але гідрат цього оксиду існує — це силікатна кислота H2SiO4.
2. Взаємодія з лугами.
Звернемося знову до досліду.
Дослід 3. Наллємо в хімічний стакан розчин натрій гідроксиду, крапнемо кілька крапель фенолфталеїну (рис. 54 а). Розчин набуває малинового забарвлення (рис. 54 6). Продуємо через зафарбований розчин вуглекислий газ. Розчин знебарвлюється (рис. 54 а).
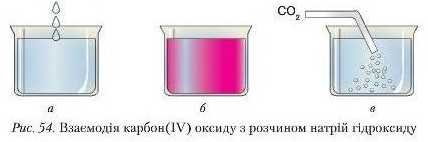
Знебарвлення розчину свідчить про те, що відбулася хімічна реакція:
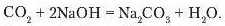
Утворилися сіль натрій карбонаті вода.
Кислотні оксиди це оксиди, яким відповідають кислоти.
Наприклад:
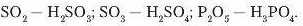
Хімічні властивості амфотерних оксидів. Поняття «амфотерність» стосується сполук, що проявляють подвійні хімічні властивості. Якщо мова йде про амфотерні оксиди, то, очевидно, вони мають проявляти властивості як основних, так і кислотних. До таких оксидів належать цинк та алюміній оксиди, оксиди тривалентного Форуму та Хрому, берилій оксид та ін.
Напишіть самостійно формули зазначених вище оксидів за їх назвами.
Розглянемо хімічні властивості амфотерних оксидів на прикладі цинк та алюміній оксидів.
3. Взаємодія з кислотами.
Якщо до цинк оксиду долити розчину сульфатної кислоти, відбувається реакція з утворенням солі цинк сульфату:
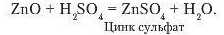
Аналогічно з кислотами реагує алюміній оксид:
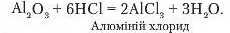
4. Взаємодія з лугами.
Реакції амфотерних оксидів із лугами відбуваються за нагрівання:
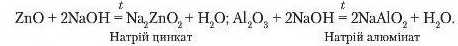
5. Взаємодія з оснбвними оксидами.
Амфотерні оксиди реагують з основними оксидами з утворенням солей:
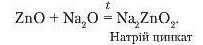
6. Взаємодія з кислотними оксидами.
За високих температур амфотерні оксиди взаємодіють з найбільш активними кислотними:
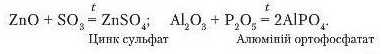
Проаналізувавши продукти реакцій амфотерних оксидів з кислотами, лугами, основними та кислотними оксидами, бачимо, що в результаті всіх цих реакцій утворюються солі.
Амфотерні оксиди це оксиди, які проявляють властивості основних і кислотних оксидів.
ПІДСУМОВУЄМО ВИВ tIEHE
• Оксидив природі перебувають у трьох агрегатних станах. Утворюють молекулярні, атомні та йонні кристалічні ґратки. Деякі мають забарвлення або можуть бути прозорі. Температури плавлення й кипіння оскидів змінюються в широкому діапазоні. Реагують з водою оксиди лужних і лужноземельних елементів.
• Оснбвним оксидамвідповідають основи. Реагують з водою, кислотами, кислотними оксидами. Під час реакцій з кислотами, кислотними оксидами утворюються солі.
• Кислотним оксидамвідповідають кислоти. Вони вступають у хімічну взаємодію з водою (виняток SiO2), оснбвними оксидами, основами. Продуктами взаємодії кислотних оксидів з оснбвними та основами є солі.
• Оснбвні й кислотні оксиди взаємодіють між собою з утворенням солей.
• Амфотерніоксиди проявляють властивості оснбвних і кислотних оксидів. Продуктами їх реакцій є солі.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Перелічіть відомі вам фізичні властивості оксидів.
2. Розпізнайте за хімічними формулами оснбвні, кислотні й амфотерні оксиди: CuO, MgO, Fe2O31 SO3, P2Ob, AI2O3, K2O, SiO2, BaO, ZnO, CO2.
3. Допишіть продукти реакцій і перетворіть їх у хімічні рівняння:
a) MgO + HCI = ...; б) K2O + H2O = ...; в) SO3+NaOH = ...;
г) SO3+ H2O = ...; OAI2O3+H2SO4 = ...; д) ZnO + NaOH = ...;
е) SO3+ ZnO = ...; є) Na2O+ CO2 = ...; ж) AI2O3+ HCI = ....
4. Опишіть практичне значення реакції взаємодії кальцій оксиду з водою.
5. Установіть, між якими з попарно взятих речовин, поданих формулами, можлива взаємодія:
a) BaO і H2O; б) SO2 і НСІ; в) SO2 і K2O; г) CaO і НСІ; ґ) K2O і NaOH;
д) CO2 і NaOH; е) SO2 і P2O6; є) BaO і H2SO4.
6. Поясніть, як експериментально перевірити, що від взаємодії оснбвних оксидів із водою утворюються луги, а кислотних — кислоти.
7. Напишіть формули оксидів за назвами й класифікуйте сполуки: калій оксид; фосфор(У) оксид; барій оксид; сульфур(УІ) оксид. Напишіть можливі реакції цих оксидів із: а) водою; б) розчином сульфатної кислоти; в) розчином натрій гідроксиду.
ЦІКАВО ЗНАТИ
Цинк оксид ZnO використовують для виробництва цинкового білила, що застосовують як фарбу в малярстві. Цей оксид входить до складу пудри, а у фармації є невід’ємною частиною присипок, суспензій, гігієнічних паст, мазей.
Великі монокристали, що добувають від сплавлення алюміній оксиду з оксидами Феруму, Купруму, Титану, Ванадію, застосовують у ювелірній справі, а суміш алюміній та хром(ІІІ) оксидів — як наждачний порошок.
Кольорове скло (рис. 55) виробляють, використовуючи комбінації різних оксидів, які додають до сировини. Наприклад, додаючи купрум(ІІ) оксид, можна одержати синьо-зелене забарвлення скляних виробів; кобальт(ІІ) оксид — синє, хром(ІІІ) оксид — зелене.

Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 19-09-2016, 00:03, Переглядів: 2483