Будова, властивості та використання оксидів
Матеріал параграфа допоможе вам:
• з'ясувати, як залежать фізичні властивості оксидів від їх будови;
• засвоїти хімічні властивості основних і кислотних оксидів;
• зрозуміти, що таке реакція обміну;
• дізнатися про сфери застосування оксидів.
Цікаво знати
За звичайних умов оксиди H2O, Cl2O7, Mn2O7 є рідинами.
Будова та фізичні властивості оксидів. Фізичні властивості оксидів, як і інших речовин, залежать від того, з яких частинок вони складаються — атомів, молекул чи йонів.
Основні оксиди мають йонну будову (мал. 51, а). Протилежно заряджені йони сильно притягуються один до одного. Тому ці оксиди за звичайних умов є твердими речовинами, плавляться за високої температури (табл. 9). Більшість йонних оксидів не розчиняється у воді, а інші, розчиняючись, реагують із нею.
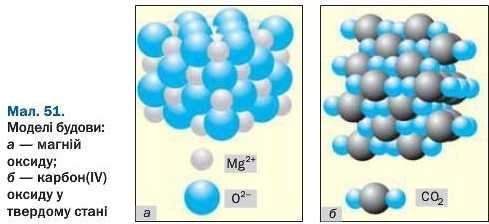
Будова і температури плавлення деяких оксидів
Таблиця 9
|
Хімічна формула |
Будова оксиду |
Температура плавлення, °С |
|
O о S3 |
Йонна — |
2630 1453 |
|
H2O SO2 |
Молекулярна |
0 -75 |
|
SiO2 |
Атомна |
1610 |
Майже всі кислотні оксиди складаються з молекул (мал. 51,6). Притягання між молекулами дуже слабке. Через це температури плавлен-ня (табл. 9) і кипіння сполук невисокі, а їх агрегатний стан за звичайних умов різний. Чимало кислотних оксидів є леткими, розчинними у воді (під час їх розчинення відбуваються хімічні реакції), деякі мають запах.
Силіцій(ІУ) оксид SiO2 і кілька інших оксидів мають атомну будову. Це тверді речовини з високими температурами плавлення (табл. 9) і кипіння. Вони не розчиняються у воді.
Хімічні властивості оксидів. Здатність оксиду до взаємодії з іншими речовинами залежить від його типу. Розглянемо реакції, у які вступають основні та кислотні оксиди. Ви вже знаєте, що основними називають оксиди, які відповідають основам, а кислотними — ті, що відповідають кислотам.
Реакції за участю основних оксидів
Реакція з водою. Вам відомо, що серед основних оксидів лише сполуки лужних і лужноземельних елементів взаємодіють із водою; при цьому утворюються основи. Така реакція відбувається, наприклад, коли змішують нега-шене вапно CaO і воду:
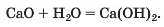
Вивести формулу продукту реакції (основи) можна, виходячи із зарядів катіона металічного елемента і гідроксид-аніона.
► Складіть рівняння реакції літій оксиду з водою.
Реакції з кислотними оксидами. Основні оксиди реагують зі сполуками протилежного хімічного характеру, тобто такими, які мають кислотні властивості. Серед них — кислотні оксиди.
Продуктом реакції між основним і кислотним оксидами є сіль. Вона складається з катіонів металічного елемента, що містилися в основному оксиді, та аніонів залишку кислоти, яка походить від кислотного оксиду.
Приклади рівнянь реакцій між основними і кислотними оксидами:
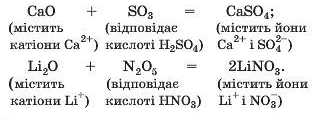
► Складіть рівняння реакції кальцій оксиду з нітроген(У) оксидом.
Реакції з кислотами. Основні оксиди взаємодіють не лише з кислотними оксидами, а й з кислотами. Продукти такої реакції — сіль і вода:
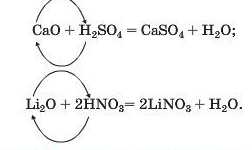
Реакції, під час яких сполуки обмінюються своїми складовими частинами, називають реакціями обміну.
Реакції за участю кислотних оксидів
Реакція з водою. Майже всі кислотні оксиди реагують із водою (виняток — оксид SiO2). При цьому утворюються оксигеновмісні кислоти:
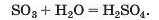
Формули кислот — продуктів реакцій кислотних оксидів із водою — виводять, складаючи разом усі атоми, наявні у формулах реагентів.
► Складіть рівняння реакції нітроген(У) оксиду з водою.
Взаємодія фосфор(У) оксиду з водою має певні особливості. Спочатку відбувається реакція:
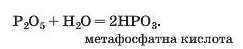
її продукт також реагує з водою, перетворюючись на іншу кислот>':
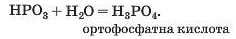
Якщо води вистачає для перебігу обох реакцій, тобто її взято в надлишку, можна записати «сумарне» хімічне рівняння:
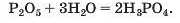
Реакції з основними оксидами. Кислотні оксиди взаємодіють зі сполуками протилежного хімічного характеру — основними оксидами та основами.
Про реакції між кислотними й основними оксидами йшлося вище. Наводимо рівняння ще однієї такої реакції за участю оксиду P2O5:
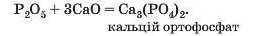
Реакції з основами. Кислотні оксиди взаємодіють з основами з утворенням солей і води:
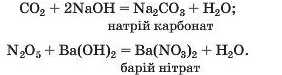
Сіль походить від кислоти, яка відповідає даному кислотному оксиду.
► Складіть рівняння реакції між сульфур(ГУ) оксидом і кальцій гідроксидом.
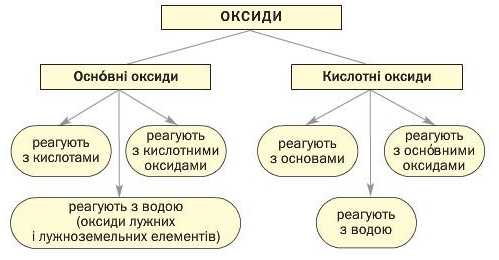
Викладений матеріал узагальнює схема 6. Чимало оксидів металічних елементів виявляють і основні, і кислотні властивості. Реакції за участю цих сполук розглянуто в § 31.
Використання оксидів. На практиці застосовують десятки оксидів. Кожен із вас знає, що найбільш уживаний оксид — вода. Із залізних руд (вони містять оксиди Феруму) добувають залізо. Кварц SiO2 є сировиною для виробництва
Схема 6
Найважливіші хімічні властивості основних і кислотних оксидів
Мал. 52. Дорогоцінне каміння: а — рубін (AI2O3 з домішкою Cr2O3); б — сапфір (AI2O3 з домішками оксидів Феруму і Титану); в — аметист (SiO2 з домішками оксидів Феруму)
кварцевого скла, яке, на відміну від звичайного, пропускає ультрафіолетові промені (під кварцевою лампою можна засмагати, як під сонцем). Пісок, що складається переважно з оксиду SiO2, використовують у виробництві скла, кераміки, а також, як і негашене вапно CaO, у будівництві. Чимало оксидів слугують реагентами на хімічних заводах. Кристали корунду Al2O3 мають високу твердість. Порошок цієї сполуки застосовують як абразивний матеріал для обробки металевих, керамічних та інших поверхонь. Деякі оксиди є основою фарб: Fe2O3 — коричневої, Cr2O3 — зеленої, TiO2 або ZnO — білої. Забарвлені домішками природні та штучні кристали оксидів Алюмінію, Силіцію (мал. 52) використовують для виробництва ювелірних прикрас.

Основні оксиди мають йонну будову. Вони є твердими речовинами, більшість із них не розчиняється у воді.
Кислотні оксиди складаються з молекул, перебувають у різних агрегатних станах, мають невисокі температури плавлення і кипіння. Майже всі ці сполуки розчиняються у воді, деякі мають запах.
Серед основних оксидів з водою реагують лише сполуки лужних і лужноземельних елементів (продукти реакцій — основи). Основні оксиди взаємодіють із кислотними оксидами і кислотами з утворенням солей.
Кислотні оксиди реагують із водою (продукти реакцій — оксигеновмісні кислоти). Вони взаємодіють з основними оксидами та основами з утворенням солей.
Реакції, під час яких сполуки обмінюються своїми складовими частинами, називають реакціями обміну.
Багато оксидів набули широкого використання в різних сферах.
205. Одна зі сполук — CI2O або Li2O — за звичайних умов є газом і має запах. Укажіть цю сполуку і поясніть свій вибір.
206. Серед наведених оксидів укажіть йонні речовини: P2O3, CI2O7, K2O1 BaO1 SO3.
207. Внесіть у відповідні клітинки таблиці формули оксидів Li2O1 Cu2O1 CI2O7, MgO, SiO2, FeO1 SO2:
|
Оксиди |
|
|
основні |
кислотні |
208. Назвіть усі основні оксиди, які реагують із водою. Напишіть два загальні рівняння таких реакцій, позначивши оксиди формулами M20 і MO.
210. Визначте, з якими речовинами правого стовпчика може реагувати кожна речовина лівого, і напишіть відповідні хімічні рівняння:
209. Допишіть схеми реакцій і складіть хімічні рівняння:

барій оксид нітратна кислота
фосфор(\/) оксид калій гідроксид
карбон(ІУ) оксид кальцій оксид
бромідна кислота
211. Складіть рівняння реакцій, під час яких утворюється магній ортофосфат, якщо реагентами є:
а) два оксиди; в) оксид і основа.
б) оксид і кислота;
212. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі послідовні перетворення:
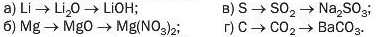
213. За матеріалами з інтернету підготуйте коротке повідомлення про застосування вуглекислого газу.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:54, Переглядів: 5258