§ 29. Властивості оксидів
Опрацювавши параграф, ви:
дізнаєтеся, як класифікують оксиди;
вивчите будову, фізичні і хімічні властивості оксидів.
1. Класифікація оксидів
Оксиди поділяють на солетворні та несолетворні.
Оксиди, які не утворюють солей, називають несолетворними.
До несолетворних оксидів належать NO, N9O, CO, SiO, GeO.
Оксиди, які під час хімічних реакцій утворюють солі, називають солетворними.
Солетворні оксиди поділяють на основні, кислотні та амфотерні. Серед сполук із загальною формулою Me9O (де Me — металічний елемент) є лише основні оксиди. До основних оксидів належить і більшість сполук, склад яких відповідає формулі MeO. Оксиди Me2O3 і MeO9 переважно є амфотерними, а сполуки Me9O., MeO3 і Me9O7 належать до кислотних оксидів (мал. 41).
Неметал Ічні елементи утворюють кислотні и несолетворні оксиди.
2. Будова і фізичні властивості основних оксидів
Основними називають оксиди, гідрати яких є основами.
До основних оксидів належать оксиди лужних і лужноземельних елементів (Магнію, Кальцію, Стронцію, Барію, Радію), а також усіх інших металічних елементів у нижчих ступенях окиснення.

Мал. 41. Оксиди металічних елементів мають різне забарвлення. Основні оксиди: а) кальцій оксид; б)магній оксид; в)купрум(ІІ) оксид. Амфотерні оксиди: г)хром(ІІІ) оксид; д)ферум(ІІІ) оксид; Кислотний оксид: е) ванадій(\/) оксид
Тип хімічного зв’язку в основних оксидах — йонний (мал. 42), тому усі основні оксиди за звичайних умов — тверді речовини з високими температурами плавлення. Не розчиняються у воді, деякі реагують з нею.
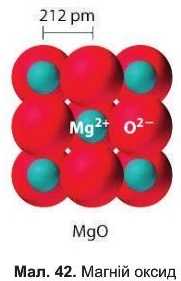
З яких йонів складається кальцій оксид, натрій оксид?
3. Хімічні властивості основних
оксидів
Взаємодія з водою.
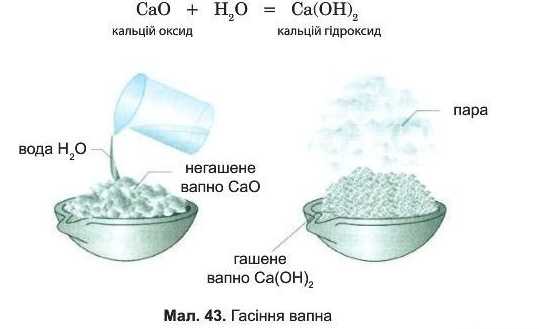
Вивчимо цю реакцію на прикладі взаємодії кальцій оксиду (у промисловості його називають негашени-ми, або паленим вапном) з водою (мал. 43). Кальцій оксид — речовина білого кольору.
Кальцій оксид помістимо у порцелянову чашку і будемо порціями додавати воду. Кальцій оксид поглинає воду, і через деякий час шматочки вапна починають розігріватися і розсипатися на дрібний порошок. Виділення теплоти — зовнішній ефект хімічної реакції. її продуктом є гашене вапно — кальцій гідроксид Ca(OH)9, що належить до класу основ:
Подібно до кальцій оксиду з водою реагують інші оксиди лужних і лужноземельних елементів, в результаті реакції з'творюють-ся основи:
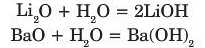
Θ Напишіть рівняння реакції між калій оксидом і водою.
До якого типу належать реакції між оксидами і водою?
Основні оксиди багатьох інших металічних елементів з водою не взаємодіють. Як правило, це оксиди, яким відповідають нерозчинні основи.
Взаємодія з кислотами.
Помістимо у пробірку чорний порошок купрум(ІІ) оксиду так, щоб прикрити дно пробірки, і додамо 1-2 мл сульфатної кислоти. Для кращого перебігу реакції суміш злегка нагріємо у полум’ї спиртівки. Помітимо, що чорний порошок розчинився, а розчин набув синього забарвлення внаслідок утворення купрум(ІІ) сульфат}', який належить до класу солей:
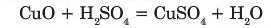
Отже, продуктами взаємодії основних оксидів з водою є сіль і вода.
Розглянемо реакції між кальцій оксидом і нітратною кислотою та натрій оксидом і хлоридною кислотою:
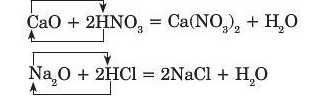
Як видно з хімічних рівнянь, реагенти обмінялися своїми складовими частинами; такі реакції називають реакціями обміну.
Реакції, під час перебігу яких складні речовини обмінюються своїми складовими, називають реакціями обміну.
4. Будова і фізичні властивості кислотних оксидів
Кислотними називають оксиди, гідрати яких є кислотами.
До кислотних належать оксиди типових неметалічних елементів — SO2, SO3, а також оксиди металічних елементів у вищих ступенях окиснення (+5 і вище): CrO3, Mn9O7.
Тип хімічного зв’язку у кислотних оксидах — ковалентний полярний. Оксиди, утворені неметалічними елементами, мають здебільшого молекулярну будову (наприклад, H9O, CO9), іноді — атомну (наприклад, SiO2).
Оксиди молекулярної будови мають невисокі температури плавлення і кипіння. За звичайних умов кислотні оксиди можуть перебувати у газоподібному стані (SO2, CO9), рідкому (Cl2O7, Mn2O7) і твердому' (P2O-, CrO3, SiO2). Чимало таких оксидів є леткими, розчинними у воді (внаслідок чого утворюються кислоти), деякі мають запах.
Оксиди з атомною будовою — тверді речовини з високими температурами плавлення і кипіння, нерозчинні у воді.
Чим вища валентність неметалічного елемента в оксиді, тим більшою мірою виражені кислотні властивості оксид}' і відповідної кислоти. Так, за звичайних умов реакція оксид}' SO9 з водою є оборотною, а оксид SO3 взаємодіє з нею повністю; кислота H2SO3 належить до кислот середньої сили, a H2SO3 — сильна.
5. Хімічні властивості кислотних оксидів
Взаємодія з водою.
Більшість кислотних оксидів взаємодіють з водою з утворенням кислот:
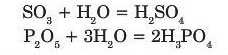
Силіцій(ІУ) оксид SiO9 із водою не взаємодіє.
І Напишіть рівняння реакції між карбон(І\/) оксидом і водою. Взаємодія з основними оксидами.
Унаслідок реакції між основними і кислотними оксидами утворюються солі, наприклад:
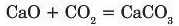
Напишіть рівняння реакції між магній оксидом і сульфур(\/І) оксидом.
Взаємодія з основами.
Кислотні оксиди взаємодіють з основами, в результаті реакції утворюються сіль і вода:
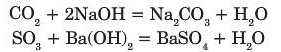
Напишіть рівняння реакції між сульфур(І\/) оксидом і калій гідроксидом. 6. Амфотерні оксиди
І Амфотерними називають оксиди, які залежно від умов виявляють властивості основних і кислотних оксидів.
Амфотерні оксиди у реакціях із кислотами і кислотними оксидами поводять себе, як основні оксиди; у реакціях із лугами і основними оксидами — як кислотні оксиди.
До амфотерних належать оксиди: BeO, Al2O3, ZnO, MnO9, Fe9O3, Cr2O3, PbO, PbO2, SnO, SnO9 та деякі інші. Цим оксидам відповідають амфотерні гідроксиди Be(OH)2, Al(OH)3, Zn(OH)2 тощо.
Усі амфотерні оксиди — йонні сполуки, тому за звичайних умов є твердими речовинами.
7. Хімічні властивості амфотерних оксидів
Амфотерні оксиди з водою не взаємодіють.
Взаємодія з кислотами.
Амфотерні оксиди взаємодіють з кислотами з утворенням солей:
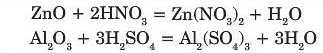
Взаємодія з кислотними оксидами.
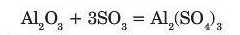
Амфотерні оксиди реагують із кислотними оксидами з утворенням солей:
Взаємодія з лугами.
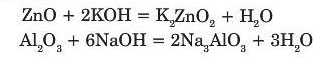
Амфотерні оксиди під час сплавляння реагують із лугами з утворенням солей:
Взаємодія з основними оксидами.
Амфотерні оксиди реагують з оксидами лужних та лужноземельних елементів з утворенням солей:
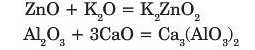
8. Вплив оксидів на довкілля
Завдяки карбон(ГУ) оксиду відбувається фотосинтез: зелені рослини поглинають із повітря CO2, засвоюють з ґрунту воду, внаслідок чого синтезують глюкозу і виділяють у повітря кисень:
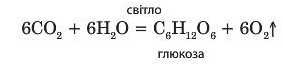
Карбон(ІУ) оксид спричинює парниковий ефект, тобто підвищення середньої температури на планеті.
Під час горіння палива, гниття органічних решток, у багатьох металургійних і хімічних виробництвах з'творюється велика кількість оксидів неметалічних елементів: CO9, SO9, SO3, NO2 та інших. Потрапляючи в атмосферу, оксиди взаємодіють з водяною парою, яка міститься в повітрі, утворюючи кислоти, і у вигляді кислотних опадів повертаються назад на землю, завдаючи великої шкоди природі й народному господарству.
— ВИСНОВКИ
Оксиди поділяють на солетворні та несолетворні, солетворні — на основні, кислотні та амфотерні.
Основними називають оксиди, гідрати яких є основами. Основні оксиди — йонні сполуки. Оксиди лужних і лужноземельних елементів взаємодіють з водою з утворенням лугів. Основні оксиди взаємодіють із кислотами з утворенням солей і води.
Кислотними називають оксиди, гідрати яких є кислотами. Кислотні оксиди мають, як правило, молекулярну будову (інколи — атомну). Кислотні оксиди реагують з водою з утворенням кислот, з основами — з утворенням солей і води, з основними оксидами — з утворенням солей.
Амфотерними називають оксиди, які залежно від умов виявляють властивості основних і кислотних оксидів. Амфотерні оксиди реагують з основними оксидами і основами, з кислотними оксидами і кислотами.
Реакції, під час перебігу яких складні речовини обмінюються своїми складовими, називають реакціями обміну.
Оксиди впливають на довкілля.
Початковий рівень
1. Які оксиди називають: а) солетворними? б) несолетворними?
2. Як поділяють солетворні оксиди?
3. Які оксиди називають основними?
4. Які оксиди називають кислотними?
5. Які реакції називають реакціями обмін}'?
6. Укажіть групу речовин, яка містить лише оксиди:
A) CaO, CaS, NO2 В) Na2Cr2O7, CrO3, Cr2O3
Б) N2O, Na2O, NaCI Г) K2O, BaO, Cu2O
Середній рівень
7. Укажіть загальну формулу вищих оксидів елементів головної підгрупи VII грз'пи:
A) E2O7 Б) E2O5 В) E2O3 Г) E2O
8. Укажіть оксид, який має йонну будову:
A) K2O Б) H2O В) P2O5 Г) SO2
9. Укажіть оксид, який має молекулярну будову:
A) Na2O Б) CO2 В) BaO Г) Li2O
10. Укажіть оксид, який має атомну будову:
A) SrO Б) SO3 В) SiO2 Г) SO2
11. Укажіть тип оксидів, які утворюють металічні елементи головної підгрупи І групи:
А) основні В) амфотерні
Б) кислотні Г) несолетворні
12. Укажіть тип оксидів, які утворюють елементи головної підгрупи VI групи:
А) основні В) амфотерні
Б) кислотні Г) несолетворні
13. Укажіть тип оксидів, утворених Магнієм, Кальцієм і Натрієм:
А) кислотні В) амфотерні
Б) основні Г) несолетворні
14. Укажіть тип оксидів, утворених Алюмінієм і Цинком:
А) кислотні В) амфотерні
Б) основні Г) несолетворні
15. Укажіть тип оксидів, утворених Фосфором і Сульфуром:
А) кислотні В) амфотерні
Б) основні Г) кислотні, основні й амфотерні
16. Укажіть формулу кислотного оксиду:
A) BaO Б) MgO В) Li2O Г) SiO2
17. Укажіть формулу основного оксиду:
ACaO Б) CaCl2 В) Ca(OH)2 DCO9
18. Укажіть формулу несолетворного оксиду:
A) CO2 Б) CO В) H2CO3 DCaCO3
19. Напишіть рівняння реакції оксидів Натрію і Кальцію з водою.
Достатній рівень
20. Укажіть протонні числа хімічних елементів, оксиди яких виявляють основні властивості:
А) 11,12 Б) 12,13 В) 13,15 Г) 6,14
21. Укажіть протонні числа хімічних елементів, вищі оксиди яких виявляють кислотні властивості:
А) 19,20 Б) 16,17 В) 20,29 D 3,4
22. Укажіть електронну конфігурацію атома елемента, оксид якого виявляє амфотерні властивості.
A) ls22s22p63s23p1 В) ls22s22p63s23p2
Б) ls22s22p63s1 D ls22s22p63s2
23. Встановіть відповідність між кількістю речовини оксиду і загальним числом йонів в оксиді:
Кількість речовини Загальне число йонів
1) 1 моль магній оксиду А) 1,204 · IO24
2) 1 моль калій оксиду Б) 1,806 · IO24
3) 2 моль барій оксиду В) 2,408 · IO24
4) 2 моль натрій оксиду Г) 3,612 · IO24
Д) 4,816 · IO24
24. Складіть рівняння хімічної реакції між фосфор(У) оксидом і кальцій оксидом.
25. Напишіть рівняння реакції оксидів Натрію, Магнію, Цинку і Алюмінію із хлоридною та нітратною кислотами.
26. Деякі оксиди застосовують у лабораторній практиці як осушувані. Які з оксидів — CuO, BaO, CaO, P9O., Fe3O1 — придатні для цього? Напишіть рівняння відповідних реакцій.
Високий рівень
27. Напишіть рівняння реакції оксидів Сульфуру(УІ), Карбону (IV), Фосфору(V) з натрій гідроксидом і кальцій гідроксидом. Дайте назви продуктам реакцій.
28. Напишіть рівняння реакцій оксидів Цинку і Алюмінію з -тутами під час сплавляння.
29. У якому варіанті відповіді вказано пару оксидів, які будуть взаємодіяти між собою:
1) CaO та SiO9
2) K2O та CaO
3) SO2 та CO2
4) CO2 та MgO
5) BaO та Na9O Варіанти відповіді.
А) 2,3 Б) 1,5 В) 3,4 Г) 1,4
30. Установіть відповідність між оксидом і продуктом його реакції з водою:
Формула оксиду Продукт реакції з водою
1) SiO2 А) кислота
2) SO3 Б) нерозчинна основа
3) Na2O В) луг
Г) реакція не відбувається
31. Установіть відповідність між реагентами і продуктами реакції:
Реагенти Продукти реакції
1) несолетворний оксид + вода А) сіль + вода
2) основний оксид + кислота Б) кислота
3) кислотний оксид + вода В) луг
4) основний оксид + вода Г) амфотерний гідроксид
Д) реакція не відбувається
32. Установіть відповідність між оксидом і продуктом його реакції з водою:
Формула оксиду Продукт реакції з водою
1) P9Ofi А) реакція не відбувається
2) CaO Б) амфотерний гідроксид
3) А1_0_ В) кислота
Δ Л
Г)основа
33. * Допишіть схеми реакцій і складіть хімічні рівняння:
SrO + H2O SiO2 + BaO
MgO + Cl2O7 I2O. + NaOH
SeO3 + H2O
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:16, Переглядів: 6056