Амфотерні оксиди та гідроксиди
Матеріал параграфа допоможе вам:
• з'ясувати, які сполуки називають амфотерними;
• зрозуміти хімічний характер амфотерних оксидів і гідроксидів;
• складати формули продуктів реакцій амфотерних сполук із кислотами, основами, оксидами.
Амфотерні сполуки. У § 11 при розгляді зміни властивостей оксидів елементів у 2-му періоді ми зазначали, що оксид BeO виявляє властивості, притаманні як основним, так і кислотним оксидам. Ця сполука, а також гідроксид Be(OH)2 взаємодіють не лише з кислотами, а й із лугами. Аналогічною є поведінка в хімічних реакціях сполук Алюмінію — оксиду Al2O3 і гідроксиду Al(OH)3.
Здатність сполуки виявляти основні та кислотні властивості називають амфотерністю22, а саму сполуку — амфотерною.
Наводимо формули найважливіших амфотерних сполук:

За будовою та фізичними властивостями амфотерні оксиди подібні до основних оксидів. Вони складаються з йонів, мають високі температури плавлення. Жодний амфотерний оксид не розчиняється у воді.
Амфотерні гідроксиди також є нерозчинними; при нагріванні вони не плавляться, а зазнають розкладу.
Хімічні властивості амфотерних оксидів і гідроксидів. Амфотерні сполуки взаємодіють із кислотними та основними оксидами, кислотами, лугами.
Цинк оксид ZnO і цинк гідроксид Zn(OH)2 реагують з кислотними оксидами, кислотами:
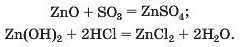
Продукти таких реакцій (солі) містять катіони Цинку Zn2 .
► Які властивості — основні чи кислотні — виявляють оксид і гідроксид Цинку в цих випадках?
Сполуки ZnO і Zn(OH)2 взаємодіють також з основними оксидами та лугами. Унаслідок реакцій утворюються солі, в яких атоми Цинку містяться в аніонах ZnO|~:
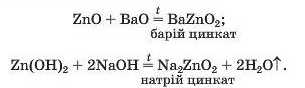
Останнє рівняння відповідає реакції за участю лугу, а не його розчину. Для того щоб формула
солі, яка утворюється, була вам зрозумілою, змінимо порядок запису елементів у формулі цинк гідроксиду на загальноприйнятий для кислот:
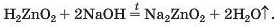
Оксид і гідроксид Цинку реагують також із водним розчином лугу за звичайних умов:
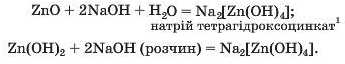
Квадратними дужками у формулах виокремлено аніон солі.
Формулу продукту двох останніх реакцій можна отримати, замінивши у формулі Na2ZnO2 два двовалентні атоми Оксигену на чотири одновалентні гідроксильні групи:
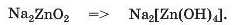
Якщо з основним оксидом або лугом реагує амфотерна сполука тривалентного елемента, то можливі два варіанти взаємодії речовин.
Розглянемо реакції між алюміній оксидом і калій гідроксидом. Продуктом однієї реакції між цими сполуками є сіль, яка походить від алюміній гідроксиду Al(OH)3 як кислоти (H3AlO3):
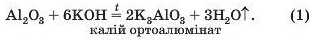
Цікаво знати
Сполука HAlO2, формулу якої часто записують як AlO(OH), трапляється в природі й утворює кілька мінералів.
Продукт іншої реакції — сіль простішого складу. Виведемо її формулу, з'ясувавши спочатку формулу' відповідної «кислоти» (насправді — амфотерної сполуки). Для цього складаємо разом усі атоми, наявні у формулах алюміній оксиду’ Al2O3 і води H2O. В отриманій формулі H2Al2O1 зменшуємо індекси удвічі (HAlO2) і замінюємо символ Гідрогену на символ Калію: KAlO2. Відповідне хімічне рівняння: 23

Зіставивши коефіцієнти перед формулами реагентів у рівняннях (1) і (2), бачимо, що орто-алюмінат утворюється при додаванні до алюміній оксиду утричі більшої кількості лугу.
Такі самі солі є продуктами реакцій за участю алюміній гідроксиду:
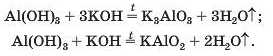
Якщо алюміній гідроксид реагує з водним розчином лугу, то утворюються солі, в яких аніони містять гідроксильні групи (реакції відбуваються за звичайних умов):
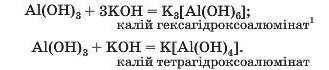
На малюнку 62 показано результат досліду, який засвідчує амфотерність хром(ІІІ) гідроксиду Cr(OH)3.

► Складіть рівняння реакцій хром(ІІІ) гідроксиду з хлоридною кислотою і розчином натрій гідроксиду.
При нагріванні амфотерні гідроксиди, як і нерозчинні основи, розкладаються на відповідні оксиди і воду: 24
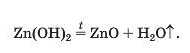
► Напишіть рівняння реакції термічного розкладу алюміній гідроксиду.
Викладений матеріал узагальнює схема 9.
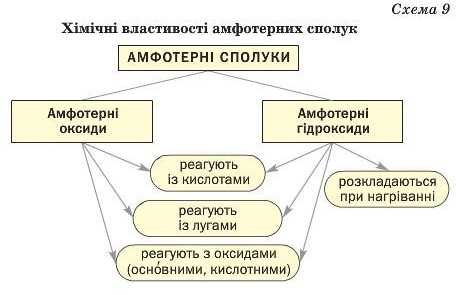
Деякі оксиди та гідроксиди металічних елементів виявляють як основні, так і кислотні властивості. їх називають амфотерними сполуками.
За фізичними властивостями амфотерні оксиди подібні до основних оксидів, а амфотерні гідроксиди — до нерозчинних основ.
Амфотерні сполуки взаємодіють із кислотами і лугами, з кислотними та основними оксидами з утворенням солей. Амфотерні гідроксиди розкладаються при нагріванні.
245. Які сполуки називають амфотерними? Назвіть кілька амфотерних оксидів і гідроксидів.
247. Допишіть схеми реакцій і складіть хімічні рівняння:

246. Допишіть схеми реакцій за участю сполук Цинку і Алюмінію та складіть хімічні рівняння:
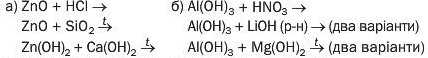
248. Складіть рівняння реакцій берилій оксиду з барій гідроксидом (при нагріванні) та розчином цієї основи.
249. Як би ви розпізнали білі порошки гідроксидів Магнію та Цинку, використавши відмінності в хімічних властивостях цих сполук?
250. Амфотерний гідроксид має відносну формульну масу 103. Що це за сполука?
251. Яка маса ферум(ІІІ) оксиду містить стільки йонів, скільки молекул міститься в 11 г карбон(ІУ) оксиду?
252. Під час термічного розкладу 39 г алюміній гідроксиду утворилося 20 г алюміній оксиду. Чи повністю розклалася сполука?
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:56, Переглядів: 14978