§ 12. Кристалічні ґратки
Відгадай, про яку речовину йдеться. Ця речовина може бути:
1. Твердою, прозорою, безбарвною.
2. Рідкою, безбарвною, без запаху й смаку.
3. Газоподібною, безкольоровою, легшою за повітря. Це вода! Вгадав?
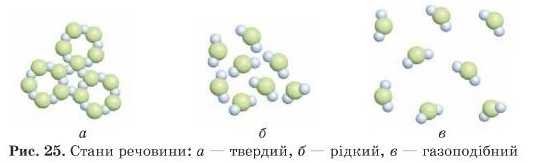
Як і багато речовин, вода існує в різних агрегатних станах: твердому, рідкому й газоподібному залежно від температури. У разі зниження температури швидкість руху молекул води в газоподібному стані сповільнюється, між ними виникають сили притягання, молекули зв’язуються між собою, і вода переходить у рідкий стан.

У рідкому середовищі через постійний рух молекули розташовані безладно або, говорячи науковою мовою, хаотично.
У разі подальшого зниження температури рух молекул іще більше сповільнюється, вони зупиняються в певних точках простору — вода твердіє, утворюючи лід (рис. 25).7
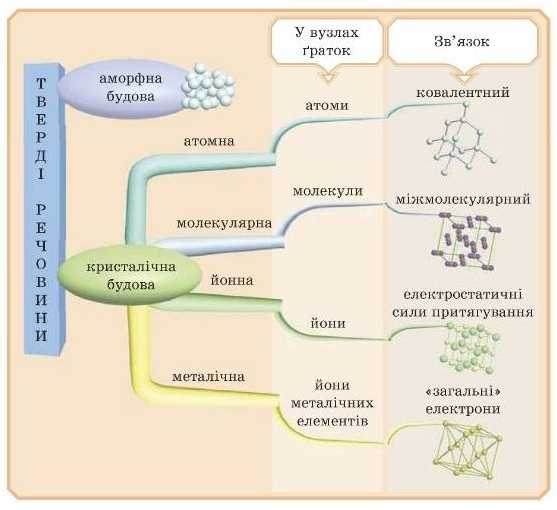
Твердий стан речовини буває двох типів — аморфний і кристалічний.
АМОРФНА БУДОВА ТВЕРДИХ РЕЧОВИН
Якщо рідку речовину «заморожувати» швидко, то молекули зупиняються в тих положеннях, в яких вони були в рідкому середовищі, тобто розташування молекул залишиться неупорядкова-ним (рис. 26). Такий твердий стан речовин називають аморфним.
В аморфних речовинах їхні складові частинки не утворюють правильної геометричної структури, розташовані новії оряд ковано.

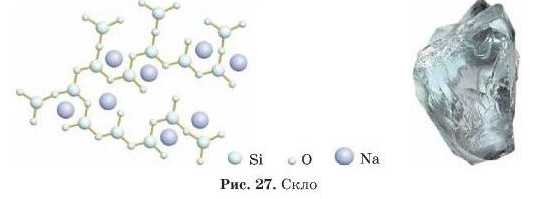
Неупорядкована будова визначає властивості аморфних речовин: вони відносно м’які, плавляться в широкому інтервалі температур. За нагрівання такі речовини поступово розм’якшуються, потім починають розтікатися й, нарешті, стають рідкими. Ви це спостерігаєте під час горіння свічки. Парафін або стеарин — речовини, з яких роблять свічки, — аморфна речовина. Прикладами аморфних речовин можуть бути скло та смоли (рис. 27).
КРИСТАЛІЧНА БУДОВА ТВЕРДИХ РЕЧОВИН
Якщо рідку воду охолоджують повільно, молекули розташовуються одна відносно одної в найбільш зручних положеннях, упорядковано.
Твердий стан речовин ;з упорядкованим розташуванням частинок називають кристалічним.

У твердої речовини кристалічної будови її складові частинки розташовані в чітко визначених точках простору (рис. 28). Якщо подумки з’єднати ці точки прямими лініями, то утвориться «каркас», який називають кристалічною ґраткою.
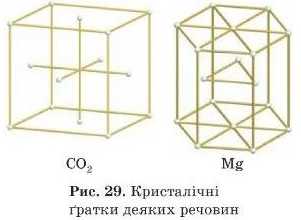
Точки, в яких розташовані частинки, називають вузлами кристалічної ґратки. У цих уявних вузлах можуть розташовуватися атоми, молекули або йони речовини (рис. 29).
Риски між кружечками — не хімічні зв’язки, а уявні лінії, які допомагають краще зрозуміти форму ґратки.
Речовини з кристалічною структурою мають цілком певну температуру плавлення й кипіння, що є важливою характеристикою речовини.
Багато речовин можуть бути переведені з аморфного стану в кристалічний, і навпаки. Так, аморфне скло після витримування за певної температури «розскловуеться», тобто в ньому з’являються дрібні кристалики, і скло каламутніє.
КРИСТАЛІЧНІ ҐРАТКИ
Відомі такі види кристалічних ґраток: атомні, йонні, молекулярні й металічні.
Атомні кристалічні ґратки
Переважна більшість твердих речовин має кристалічну будову.

У вузлах атомних кристалічних ґраток розташовані атоми речовини, які з’єднані між собою ковалентними зв’язками.
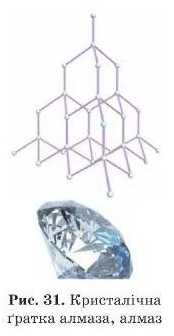
Приклади: кварц (SiO2), алмаз (С), корунд (Al2O3), графіт (('), бор (В), кремній (Si), карборунд (Si(J) та ін. (рис. 32).
Для переходу в рідкий стан речовин з атомною ґраткою доводиться розривати міцні ковалентні зв’язки між атомами. Тому речовини з такою структурою або плавляться за дуже високих температур, як, наприклад, кварц (SiO2) або корунд (Al2O3), або не плавляться взагалі графіт» алмаз, бор, кремній. Такі речовини під час сильного нагрівання просто руйнуються.
Оскільки руйнування кристалічної ґратки супроводжується розривом хімічних зв’язків, плавлення таких речовин супроводжується їх розкладанням. Утворюються, наприклад, окремі молекули SiO2 або атоми С.
Речовини, які мають атомну кристалічну ґратку, тверді, але крихкі й не розчиняються у воді. Майже всі вони не проводять електричний струм (винятком с, наприклад, графіт), хімічно інертні, не розчиняються в розчинниках.
Алмаз відрізняється високою твердістю. Твердість — це здатність матеріалів чинити опір проникненню в них інших твер дих тіл. Не слід плутати твердість і крихкість. Алмаз можи* дряпати або обробляти тільки іншим алмазом, інші речовини не за лишать па ньому й сліду вій твердий, але його можна роздрібнити сильним ударом — він крихкий. Завдяки високій твердості алмази використовують як ріжучий і шліфувальний матеріал.
- ДІЗНАЙТЕСЯ БІЛЬШЕ
Вартість алмазів залежить від чистоти та прозорості каменю й від його маси, яку вимірюють у каратах (1 карат = 0,2 г). Найбільшим алмазам дають імена.
Наприклад, найбільший алмаз одержав ім’я «Куллінан». Його було знайдено 1905 р. у Південній Африці. Первісна маса алмаза становила 3106 карат, тобто 621 г.

Молекулярні кристалічні ґратки
У вузлах молекулярних кристалічних граток розташовані молекули, які можуть бути полярними й неполярними. Зв’язки між молекулами слабкі.
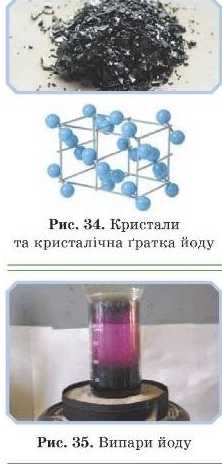
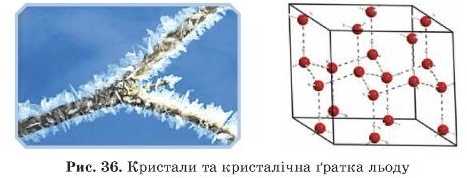
Молекулярну структуру ґратки мають більшість органічних речовин, деякі тверді за звичайних умов неметали (сірка, йод, білий фосфор) і складні речовини (вода, кислоти), а також усі гази у твердому стані (рис. 34. 36).
ДІЗНАЙТЕСЯ БІЛЬШЕ
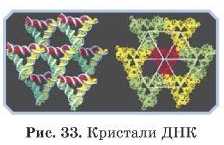
Деякі великі молекули, такі як ДНК, також здатні кристалізуватиея. Ґратка кристалічної ДНК молекулярна. Очищені віруси теж утворюють кристал і ч ні ст руктур и.
Молекулярні ґратки легко зруйнувати. Тому речовини з такою будовою мають відносно низьку температуру кипіння, невелику твердість, часто леткі, тобто легко переходять у газоподібний стан. Багато з таких речовин є твердими й кристалічними лише за низьких температур.
Щоб перевести гази у твердий стан, часто потрібна дуже низька температура. Для азоту, наприклад, температура мас становити -210 cC.
Якщо в молекулах зв’язки ковалентні неполярні, то утворені ними речовини майже не розчинні у воді, а їх розчини не проводять електричний струм.
Наприклад, кисень, азот.
Деякі речовини, які мають у молекулах ковалентні полярні зв’язки, добре розчиняються у воді, а їх розчини проводять струм. Наприклад, гідроген хлорид, гідроген бромід та інші кислоти, амоніак і т. д.
ДІЗНАЙТЕСЯ БІЛЬШЕ
Кристали йоду мають цікаву особливість: переходять у газоподібний стан, минаючи рідкий (явище сублімації). Тому, якщо залишити кристали йоду у відкритому посуді, через час вони зникнуть. Сублімація підсилюється за нагрівання. Випари йоду мають красиве фіолетове забарвлення.
Вода у твердому стані (лід) теж утворює молекулярні кристалічні ґратки.
Йонні кристалічні ґратки
У вузлах йонних кристалічних ґраток розташовані йони, зв’язані один з одним йонним зв’язком.
Приклади: майже всі солі, луги, сполуки активних металів з неметалами (рис. 37, 38).
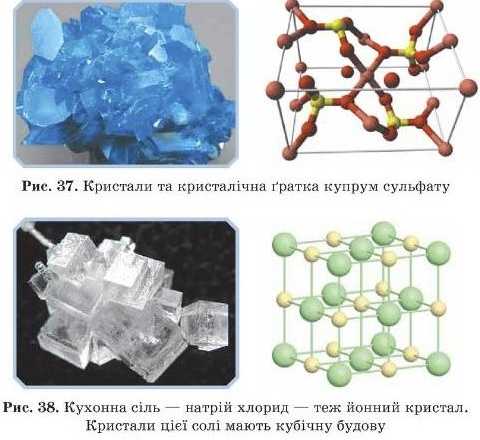
Речовини з йонною ґраткою тугоплавкі, малолсткі, мають високу твердість, але крихкі, їх розплави й водні розчини проводять електричний струм. Ці речовини добре розчиняються в полярних рідинах (наприклад, у воді).
ДІЗНАЙТЕСЯ БІЛЬШЕ

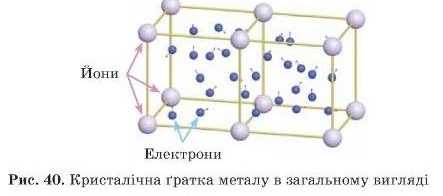
Метали та їх сплави мають металічні кристалічні гратки (рис. 41). Вони складаються з катіонів металу, зв’язаних загальними валентними електронами, які можуть пересуваються по всьому зразку металу. їх навіть образно називають «електронний газ». Електрони, які вільно рухаються, визначають специфічні властивості металів (рис. 40). У більшості з них різні температури плавлення, але частіше високі, вони нелеткі, тверді та пластичні, їх можна кувати й розкату-вати, вони добре проводять електричний струм і тепло, не розчинні у воді.
Цікаво, що деякі метали мають низьку температуру плавлення. Наприклад, ртуть плавиться приблизно за 39 °С, а галій — за +30 °С (плавиться в руці), у той час як tUA вольфраму +3422 °С. Найпластичніший метал — золото. Його можна розкотити в пластини тонше волосся, а 1 см'! золота можна витягнути в нитку завдовжки до 2 км. Найкрихкіший метал — хром.
Отже, знаючи тип кристалічної ґратки, ми можемо припустити властивості речовини, і навпаки.

Зверніть увагу няланцюг причини о- н я CJі і д ко во і ό взає м оз в’язку:
Отже, із цього параграфа ми дізналися:
ДІЗНАЙТЕСЯ БІЛЬШЕ
Рідкі кристали
Сьогодні про рідкокристалічні дисплеї, або LCD-дисплеї (під англ. LCD — Liquid Crystal Display) знають усі. Екран телевізора або телефону, електронний годинник, екрани різних вимірювальних приладів і т. д. усі воші ґрунтуються на виняткових властивостях рідких кристалів. Багато життєво важливих процесів у нашому організмі теж пов’язані з рідкими кристалами. Що ж це таке?
Рідкі кристали (PK) унікальні речовини, які мають властивості кристалів — упорядковану структуру — і властивості рідини — текучість. PK утворюють найчастіше великі органічні молекули, які мають форму дисків або довгих паличок. Кристалічна ґратка молекулярна. Ці молекули розташовані в чітко визначених точках простору (як у кристалі), але можуть узгоджено змінювати положення розгортатися або вигинатися. Для здійснення таких рухів потрібно дуже мало енергії. Це може бути дуже слабкий електричний струм або навіть механічний вплив. Під час переміщення молекул можуть змінюватися колір або прозорість речовини. Це все ми спостерігаємо, дивлячись на екран телефону. Потрібно зовсім небагато електричної енергії від акумулятора, щоби на ньому з’явилися літери або зображення.
ПЕРЕВІРТЕ СВОЇ ЗНАННЯ
1. Які можливі будови твердих тіл? Чим ці будови розрізняються?
2. Назвіть типи кристалічних ґраток.
3. Дайте характеристику речовинам з молекулярною, атомною, йонною ґраткою.
ВИКОНАЙТЕ ЗАВДАННЯ
1. Уважно прочитайте текст, підкресліть помилки. Перепишіть його без помилок.
Дмитрик Менделєєв написав самостійну роботу з хімії: «Валентність це кількість неспарених електронів у атомі. Кисень і сірка, наприклад, завжди двовалентні. Сума ступенів окиснення в атомі дорівнює нулю. У натрій сульфаті, наприклад,
сірка має ступінь окиснення +4, натрій--ні, а кисень--2.
Менш електронегативні елементи в сполуці притягують до себе
електрони й заряджаються негативно, а елементи з більшою електропегативіїістю легко віддають електрони й заряджаються позитивно. Якщо електронегативності елементів у сполуці однакові, то зв’язок між ними ковалентний полярний, різні — ковалентний неполярний. Йонний зв’язок існує в металах. Саме він визначає електропровідність і теплопровідність металів. Молеку-ли з йонною кристалічною ґрат кою добре розчиняються у воді, але їх розчини не проводять електричний струм. Речовини з молекулярною ґраткою мають у вузлах атоми, зв’язок між якими ковалентний неполярний, дуже міцний. Tx розплави добре проводять електричний струм. Речовини з атомною ґраткою тверді та пластичні, їх можна кувати, вони добре розчиняються у воді».
2. Установіть відповідності.
Ти п кри с т ал і ч н ої В ласт и в ост і
Гратки речовини
1. Молекулярні а) Тверді, крихкі, нелеткі, мають висо-
2. Йонні кі температури плавлення, розчинні
3. Атомні у воді, їх розчини й розплави проводять
електричний струм
б) Тверді, нерозчинні у воді, діелектрики або напівпровідники, нелеткі
в) М’які, нелеткі, невисокі температури кипіння й плавлення, електричний струм не проводять
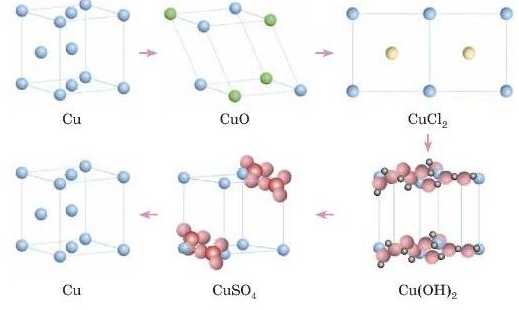
3. Перед вами схема перетворень у вигляді кристалічних ґраток. Спробуйте написати рівняння реакцій, які відповідають їм.
4. (’кладіть формули сполук: а) Магнію та Флуору; б) Гідрогену й Брому; в) Карбону й Оксигепу; г) Натрію й Оксигену. Укажіть вид хімічного зв’язку в кожній із них.
5. Визначте вид хімічного зв’язку й складіть формули сполук:
а) Силіцію з Хлором; б) Нітрогену з Гідрогеном; в) Карбону з Флуором; г) простої речовини — йоду. Дайте їм назви.
6. Зобразіть електронні схеми будови: а) молекул брому й гідроген сульфіду; б) сполук Фосфору з Гідрогеном і Оксигену з Флуором. Укажіть тип хімічного зв’язку.
7. Складіть формули водневих сполук елементів 3-го періоду, розташуйте їх в один горизонтальний ряд і поясніть, як змінюється характер зв’язку в цьому ряді зліва направо. Чому відбуваються ці зміни?
8. Визначте тип кристалічної ґратки в речовинах: кремній, сульфур(ІУ) оксид, бронза, магній флуорид. Опишіть їхні фізичні властивості.
9. Формула кварцу — SiO2, а вуглекислого газу — CO2. У якому випадку формула виражає справжній склад молекули, а в якому тільки відношення числа атомів одного та другого елементів? Чому, на відміну від вуглекислого газу, кварце важко-плавкою речовиною?
ДЛЯ ДОПИТЛИВИХ
1. Для хімічного експерименту нам потрібний розчин, який проводить електричний струм. Речовину з якою ґраткою потрібно взяти для цього? Порадьте конкретні речовини.
2. Речовини з якою кристалічною ґраткою використовують парфумери?
3. Чи буде розчин цукру проводити струм?
4. Чому цукор можна розплавити в ложці, а сіль ні?
5. Чому сіллю можна чистити, наприклад, посуд? (Пробувати нетреба, можна подряпати покриття)
6. Чому з алюмінію можна зробити дріт, а з кристала солі ні?
7. Раніше, у XIX столітті, листи запечатували, крапаючи на них розплавленою речовиною, яку називали сургучем. Він скріплював аркуші листа, а потім, поки сургуч був теплим, на ньому ставили відбиток печатки (звідси й вираз запечатати листа). Під час охолодження сургуч поступово тверднув. Λ ще раніше для цього використовували віск. Що ви можете сказати про будову цих речовин? Які речовини ви ще могли б порадити для цього?
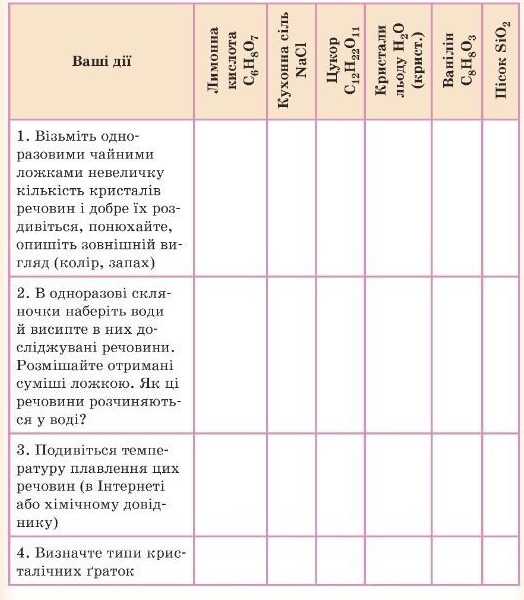
ДОМАШНІЙ ЕКСПЕРИМЕНТ
Вивчення властивостей речовин і визначення типів кристалічних ґраток
(Просимо допомоги батьків!)
Перед виконанням експерименту треба підготувати собі на кухні робоче місце, надіти спеціальний одяг, заслати стіл клейонкою, користуватися спеціальним посудом і обладнанням. Після закінчення ппГмті iifif» ііпибпяти та ппмити nvicu.
ДОДАТКОВІ ЗАВДАННЯ
1. Наведіть приклади речовин з різним типом кристалічних Граток. Поясніть, які фізичні властивості мають ці сполуки.
2. Кристалічний йод є леткою сполукою. Який тип кристалічної граток характерний для нього?
3. Білий фосфор має температуру плавлення +44 °С, червоний
фосфор--1-250 °С, а чорний--Ь4()() °С. Чи однаковий тип
кристалічних ґраток мають різновиди фосфору? Поясніть свою точку зору.
4. Кристали карборунду SiC займають друге місце за твердістю після алмазу й мають температуру плавлення і 2830 °С. Який тип кристалічних ґраток характерний для них?
5. Кристали корунду Al2O3 плавляться за температури +2050 °С. Чи можна стверджувати, що вони мають таку саму кристалічну ґратку, що й кристали карборунду? Поясніть свою точку зору.
6. Солі натрій хлорид і натрій йодид мають однакову кристалічну ґратку. Ці сполуки будуть легкоплавкими чи тугоплавкими? Поясніть свою точку зору.
7. Солодка кристалічна сполука глюкоза CiiII12O6 (її ще називають виноградним цукром) плавиться за температури +146...+ 150 °С. Чи можете ви її розплавити в домашніх умовах? Який тип кристалічних ґраток характерний для цієї сполуки?
8. Деяка сполука за звичайних умов є газом X2. Перехід у твердий стан відбувається за температури t = - 210 °С. Який тип кристалічних ґраток має ця сполука у твердому стані? Який тип хімічного зв’язку в молекулах цієї сполуки?
9. Який тип кристалічних ґраток характерний для летких водневих сполук неметалічних елементів?
10. Чому оксиди металічних елементів завжди є кристалічними сполуками на відміну від оксидів неметалічних елементів? Який тип кристалічних ґраток характерний для них?
11.Чому не можна говорити «молекула солі», «молекула лугу»?
12. Як експериментально довести, що крім речовин молекулярної будови є речовини немолекулярної будови?
13. Як найпростіше експериментально розпізнати однакові за розміром алмаз і лід? Яка з цих речовин має молекулярну будову?
14. Для виробництва всіх видів скла застосовують кварцовий пісок, який розплавляють з іншими компонентами в електричних печах. Чи є це виробництво енерговитратним? Чи можете ви в домашніх умовах розплавити пісок?
Це матеріал з підручника Хімія 8 клас Гранкіна
Автор: admin от 21-09-2016, 00:03, Переглядів: 12087