§ 20. Кристалічні ґратки
Опрацювавши параграф, ви дізнаєтеся:
про будову і властивості твердих тіл; про атомні, йонні та молекулярні кристали;
про фізичні властивості речовин із різними типами кристалічних ґраток.
1. Властивості і будова твердих речовин
Тверді речовини різноманітні за властивостями: вони мають різну густину, бувають кольоровими та безбарвними, пластичними і крихкими; можуть проводити електричний струм, притягуватись магнітом. Під час нагрівання до певної температури багато твердих речовин плавляться, тобто перетворюються на рідину, а деякі (йод, нафталін) сублімують — одразу переходять в газуватий стан, минаючи рідкий. Деякі тверді речовини, наприклад малахіт, під час нагрівання розкладаються.
Усі тіла, які складаються з твердих речовин, на відміну від рідких та газуватих, мають певну форму і об’єм. Ці властивості пояснюються тим, що частинки, які утворюють тверде тіло, не можуть вільно рухатись одна відносно іншої.
За будовою і фізичними властивостями тверді речовини поділяють на аморфні та кристалічні. Аморфні речовини не мають впорядкованої структури, окремі частинки в них розміщені хаотично, недарма слово «аморфос» перекладається з грецької мови як «той, що не має форми». Прикладами таких речовин є смоли, гума, більшість полімерів, тобто речовини, які складаються з дуже великих молекул. Під час нагрівання вони не плавляться при певній температурі, а постійно розм’якшуються, перетворюючись на рідину.

Переважна більшість твердих речовин, у тому числі, добре відомі вам кухонна сіль та цукор, мають кристалічну будову, тобто складаються із кристалів. Окремі кристали мають форму симетричних многогранників — куба, октаедра, піраміди, призми тощо (мая. 20). Проте великі правильні кристали трапляються рідко. Зазвичай зустрічають зрощені кристали чи їх уламки. Якщо кристалічну речовину подрібнити до порошку, то побачити кристали не можна навіть у потужний мікроскоп, але речовина при цьому все одно зберігає кристалічну будову.
Кристали кухонної солі часто мають форму куба. Якщо натиснути на такий кристал лезом ножа, то він не розсипається на порошок, а розпадається на окремі шматки, кожен із яких хоча б частково зберігає форму початкового кристала (мал. 21).


Це свідчить про те, що частинки в кристалах розміщені у певному порядку і утворюють правильну геометричну структуру — кристалічні ґратки.
Точки, в яких містяться частинки, називають вузлами гратки.
За зовнішнім виглядом кристалу можна зробити висновок про розміщення частинок з' кристалічних гратках. Легко помітити, наприклад, що для кухонної солі характерні кубічні гратки. Кристали льоду мають шестикз'тну (гексагональну) форму (мал. 22).
Така ж симетрія характерна і для окремих сніжинок.
Форми кристалів однієї і тієї ж речовини можуть бз'ти дуже різноманітними, оскільки залежно від умов (температз'ра і розчинник) різні грані кристалів ростуть з різною швидкістю. Кристали кухонної
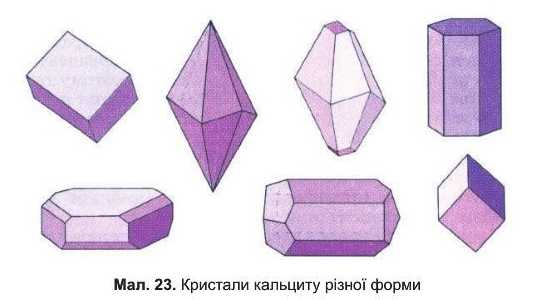
солі, які виросли з розчину, що містить домішки інших речовин, мають форму октаедрів. Особливо різноманітні форми кристалів кальциту — однієї з різновидів кальцій карбонату (мсш. 23).
Залежно від характер}' частинок, які утворюють кристал, і від типу хімічного зв’язку між ними розрізняють чотири типи кристалічних ґраток: атомні, йонні, молекулярні і металічні. (Металічні кристилічиі ґратки вибчшоться у курсі хімії дещо піопіше).
2. Атомні кристалічні ґратки
У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені один з одним ковалентними зв’язками. Наприклад, у кристалі алмазу атоми Карбону утворюють просторовий тривимірний каркас, в якому кожен атом сполучений з чотирма іншими (мал. 24). Число найближчих сусідів атома називають координаційним числом. У кристалах кварц}' SiO9 (мол. 25) кожен атом Силіцію сполучений з чотирма атомами Оксигену, а кожен атом Оксигену — з двома атомами Силіцію.
Ковалентні зв’язки в атомних кристалах надзвичайно міцні, тому речовини з атомними ґратками практично нерозчинні у воді. Щоб зруйнувати ковалентні зв’язки, необхідна велика енергія, тому такі речовини мають високі температури плавлення і кипіння. Ачмаз, наприклад, плавиться при температурі близько 4000 C і підвищеному тиску.

U
3. Ионні кристалічні ґратки
У вузлах йонних кристалів містяться різнойменно заряджені йони, які утримуються за рахунок електростатичного притягання. Координаційне число кожного йона залежить від його радіуса.
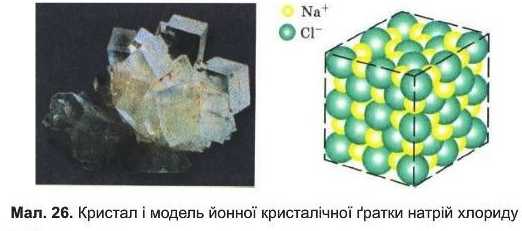
Ионні кристалічні ґратки характерні для речовин з йонним зв’язком. (Пригадайте, що речовини з йонним зв’язком називають йонними сполуками). Як приклад розглянемо кристалічні ґратки кухонної солі — натрій хлориду (мал. 26).
У натрій хлориді йони Натрію та Хлору чергуються таким чином, що кожен йон Na* знаходиться в оточенні шести йонів СІ", а кожен йон Cl- оточений шістьма йонами Na'. Це означає, що координаційне число обох йонів дорівнює шести.
Речовини з йонними кристалічними ґратками досить тугоплавкі і часто добре розчинні у воді. Вони майже нелеткі і саме тому не
о
мають запаху. Ионні кристали не проводять електричний струм, оскільки в них немає вільних електронів, а самі йони не можуть
вільно переміщатися по кристал}'. Ионні сполуки крихкі, оскільки навіть невеликий зсув частинок у кристалічних ґратках наближають один до одного однойменно заряджені йони, відштовхування між якими призводить до появи тріщин у кристалі і, навіть, до його руйнування.
4. Молекулярні кристалічні ґратки
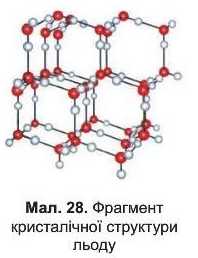
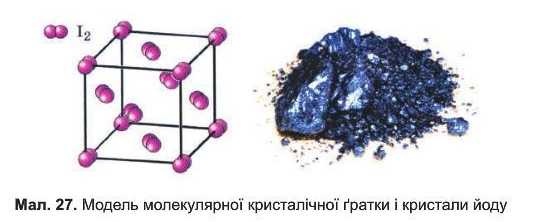
Молекулярні кристали складаються з молекул, які слабко притягуються одна до одної. Наприклад, кристали йоду складаються з молекул I9 (мал. 27), а в вузлах кристалічних ґраток льоду містяться молекули H9O (мал. 28).
Молекулярну структуру мають у твердому стані багато сполук неметалічних елементів — вуглекислий газ CO2 («сухий лід»), амоніак NH3, гідроген хлорид НС1, а також більшість органічних сполук, наприклад, етанол C2H5OH, глюкоза CfH12Ofi, сахароза C12H22O11 та інші. Такі сполуки називають молекулярними.
У молекулярних кристалах зв’язки між молекулами значно слабші, ніж між атомами в молекулі. Ці зв’язки легко зруйнувати, тому речовини, які у твердому стані мають молекулярні кристалічні ґратки, плавляться і киплять при низькій температурі. За звичайних умов вони є газами, рідинами чи легкоплавкими твердими речовинами. Багато молекулярних сполук мають запах.
Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови.
1. Розгляньте натрій хлорид. Який агрегатний стан натрій хлориду за звичайних умов?
2. До кристалічних чи аморфних речовин належить ця речовина?
3. Декілька кристалів натрій хлорид}' покладіть у порцелянову ступку і обережно розітріть товкачиком. Чи вдається його подрібнити?
4. Ложечкою для сипучих речовин насипте у пробірку натрій хлорид, долийте 3—4 мл води і розмішайте скляною паличкою. Чи розчиняється натрій хлорид у воді?
5. Запишіть температуру плавлення натрій хлорид}'.
6. Розгляньте пісок. Який агрегатний стан силщій(ІУ) оксиду за звичайних умов?
7. До кристалічних чи аморфних речовин належить ця речовина?
8. Декілька кристалів піску покладіть у порцелянову ступку і спробуйте розтерти товкачиком. Чи вдається його подрібнити?
9. Ложечкою для сипучих речовин насипте пісок у пробірку, долийте 3-4 мл води і розмішайте скляною паличкою. Чи розчиняється пісок у воді?
10. Запишіть температуру плавлення піску.
11. Який агрегатний стан води за звичайних умов?
12. Запишіть температуру замерзання і температуру кипіння води.
...деякі речовини (наприклад, сірка S і кварц SiO2) можуть
мати як кристалічну, так і аморфну будову.
— ВИСНОВКИ —
Тверді речовини бувають кристалічними та аморфними. У кристалах частинки строго впорядковані і утворюють кристалічні ґратки, а в аморфних вони розміщенні хаотично.
Залежно від характеру частинок, які утворюють кристали, розрізняють атомні, йонні і молекулярні кристалічні ґратки.
Речовини з атомними ґратками практично нерозчинні у воді, мають високі температури плавлення і кипіння.
Речовини з йонними кристалічними ґратками тугоплавкі, часто добре розчинні у воді, не проводять електричний струм, крихкі.
Речовини з молекулярними кристалічними ґратками плавляться і киплять при низькій температурі; за звичайних умов вони є газами, рідинами чи легкоплавкими твердими речовинами; багато сполук мають запах.
Початковий рівень
1. Назвіть спільні властивості усіх твердих речовин.
2. Чим відрізняються кристалічні речовини від аморфних?
3. Наведіть приклади кристалічних і аморфних речовин.
Середній рівень
4. Дайте визначення понять: кристалічні ґратки, координаційне число.
5. Наведіть по одном}' прикладу твердих речовин які під час нагрівання: а) розкладаються; б) плавляться; в) сублімують.
Достатній рівень
6. Карборунд (силіцій карбід SiC) має температуру плавлення 2830 °С і по твердості близький до алмазу. Який тип кристалічних ґраток має ця речовина?
7. Ванілін — безколірна кристалічна речовина з приємним запахом. Які кристалічні ґратки він має?
8. Деяка безколірна речовина добре розчинна у воді і має високу температуру кипіння. Зробіть припущення про тип її кристалічних ґраток. Чи має ця речовина запах?
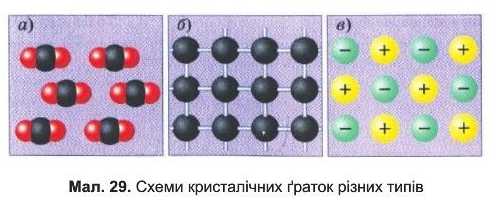
9. На малюнку 29 наведені схеми трьох типів кристалічних ґраток. Назвіть їх і наведіть по одному приклад}' речовин кожного тип}'.
10. Заповніть таблицю.
|
Властивості |
Типи кристалічних ґраток |
||
|
речовин |
Атомні |
Йонні |
Молекулярні |
|
Температури плавлення і кипіння |
|||
|
Запах |
|||
|
Розчинність у воді |
|||
|
Приклади речовин |
|||
Високий рівень
11. Визначте ступінь окиснення, валентність і координаційне число атомів Карбону в алмазі.
12. Із поданого переліку випишіть окремо формули речовин з кристалічними ґратками: а) атомними б) йонними в) молекулярними. CaCl2, 02(тв.), CuO, Вг2(тв.), С(алмаз), NaNO3, HCl (тв.), KBr, CO2Otb.), H2Oira.).
13. Білий фосфор плавиться при 44 С, а червоний фосфор при значно вищій температурі. Який висновок можна зробити про типи їхніх кристалічних граток?
14. * Поясніть, чому кварц SiO2 і вуглекислий газ CO9 мають різні
фізичні властивості попри подібний склад. Укажіть типи кристалічних ґраток у цих речовинах.
Виконайте навчальний проект 3. Залежність фізичних властивостей речовин від типів кристалічних ґраток.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:12, Переглядів: 15782