§ 16. Кристалічні ґратки. Атомні, молекулярні та йонні кристали
Опанувавши матеріал параграфа, ви зможете:
• розрізняти кристалічні ґратки речовин;
• знати будову різних типів кристалічних граток: молекулярних, йоіших, атомних;
• пояснювати розташування структурних частинок у кристалічних гратках, силу зв’язку між частинками, взаємозв’язок між будовою кристалічної ґратки та властивостями сполук;
• характеризувати залежність властивостей речовин від типу кристалічної ґратки.
Кристалічна будова речовин. З курсу природознавства та фізики ви знаєте, що за звичайних умов речовини перебувають у трьох агрегатних станах.
Назвіть ці три стани, поясніть перехід з одного в інший на прикладі води.
Але рідину чи газ за певних умов (пониження температури, тиску) можна перевести в твердий стан. Процес твердіння речовин це процес упорядкування структурних частинок речовини в просторі. Внаслідок твердіння утворюються кристалічні структури, що нагадують ґратки. Місця розташування структурних частинок у ґратках називають вузлами. У вузлах кристалічних ґраток розташовуються молекули, йони або атоми. Відповідно, розрізняють гри типи кристалічних ґраток: молекулярну, йонну, атомну. Розглянемо структуру кожної з них.
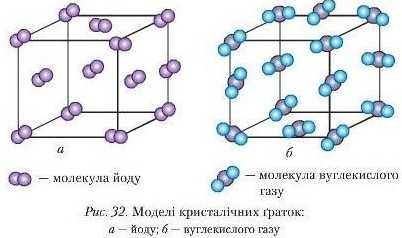
Молекулярні кристалічні ґратки. Вони характерні для речовин молекулярної будови. У вузлах молекулярної ґратки розташовуються молекули речовин із ковалентним зв’язком. Залежно від виду нього зв’язку розрізняють і види молекулярних ґраток: неполярнуй полярну.
У вузлах неполярної молекулярної ґратки розміщуються неполярні молекули, що притягуються дуже слабкими міжмолекулярними силами взаємодії (вандерваалівськими). Такою є кристалічна ґратка йоду (рис. 32 а).
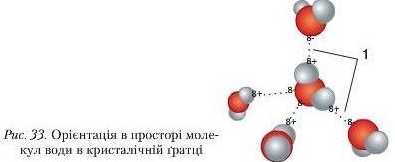
У вузлах кристалічних іраток речовин із полярним ковалентним зв'язком теж розташовуються молекули, які в певному порядку орієнтуються одна до одної полюсами молекул (рис. 33).
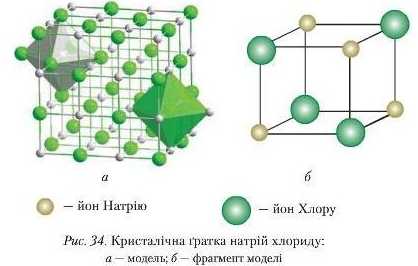
Йонна кристалічна ґратка властива для речовин із йониим зв’язком. У вузлах ґратки розташовані йопи двох видів: позитивно заряджені (катіони) та негативно заряджені (аніони).
Йоііи розташовуються в шахматиому порядку й утримуються силами взаємного притягання.
Прикладом служить кристалічна іратка натрій хлориду. Навколо кожного позитивно зарядженого нона Натрію (Na*) розміщуються шість негативно заряджених йоиів Хлору (СІ-) і навпаки. Спрощено кристал NaCl можна зобразити так (рис. 34):
У природі трапляється багато речовин із йошіими кристалічними ґратками. Це оксиди, основи й солі. На рисунку 35 представлено кристали морської солі (а) й аметисту (6).
Сили притягання між різнойменно зарядженими частинками великі, відповідно йонні зв'язки міцні. Типовими представниками таких сполук є солі: натрій хлорид, калій нітрат, натрій нітрат та ін.

Атомна кристалічна ґратка спостерігається в сполуках і я ковалентними зв’язками. У вузлах такої Гратки розташовуються атоми. Усі ці зв'язки є рівноцінними та міцними. Прикладом є кристалічні ґратки алмазу, силі цій (IV) оксиду.
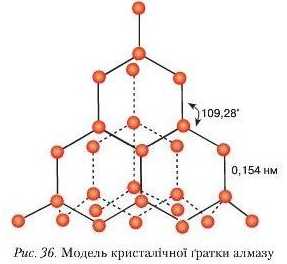
Кристалічна ґратка алмазу складається з атомів Карбону, кожен з яких сполучений із чотирма іншими під кутом 109°2£ Такий кут характерний для геометричної фігури тетраедра. У центрі тетраедра розміщений атом Карбону, а на вершинах — чотири інші (рис. 36). Зв'язки між атомами в атомній кристалічній ґратці є дуже міцним, тому на їх розрив витрачається велика кількість енергії.
Залежність фізичних властивостей речовин від типів кристалічних ґраток. Розглянемо фізичні властивості речовин з різним типом кристалічних ґраток.
Молекули речовин, що утворюють молекулярні кристалічні ґратки, слабко утримують одна одну в ґратці.
Пригадайте, який тип хімічного зв’язку наявний у сполуках з молекулярними кристалічними ґратками.
Якщо ж між молекулами діють слабкі сили притягання, то зв’язок між ними можна легко розірвати. Це зумовлює такі властивості: висока леткість, легкоплавкість, низькі температури кипіння, м'якість. Наприклад, у йоду настільки слабкі сили
взаємодії між молекулами, що навіть за незначного нагрівання його кристали перетворюються в газоподібний стан (пару), минаючи рідкий. Вам відомо, що й амоніак, який входить до складу нашатирного спирту, за звичайних умов легко випаровується тощо.
Наведіть приклади інших речовин із молекулярною кристалічною ґраткою.
Речовини з йтаїими кристалічними Гратками відзначаються високою твердістю, оскільки сили взаємодії між різнойменно зарядженими йонами великі й однаково діють у всіх напрямках. На розрив йонпих зв'язків ви трачається багато енергії. Наприклад, щоб розплавити кухонну сіль, необхідно нагріти її до температури понад 800 nC, а щоб сіль кипіла вище 1400 °С. З цим пов'язана й тугоплавкість, й відсутність леткості. Переважна більшість речовин із йопними ґратками добре розчинні у воді. Якщо йоппі сполуки у твердому стані не проводять електричного струму, то в розчинах є електропровідними. Йонні кристалічні ґратки міцніші за молекулярні, але слабші, ніж атомні.
Речовини з атомними кристалічними ґратками подібні за властивостями до йопиих. Вони характеризуються: а) міцністю кристалів; б) високими температурами плавлення та кипіння;
в) твердістю; г) крихкістю; ґ) майже нерозчинні у воді й інших рідинах. Очевидним є той факт, що ковалентні зв’язки між атомами є ще міцніші, ніж між йолами в йонпих сполуках. Твердість алмазу порівняно з іншими твердими речовинами є найвищою. До речовин з атомними кристалічними ґратками належить ква|щ (силіцій(ІУ) оксид) і його ]>ізповиди (рис. 37).

|
Речо вина |
кристалічної ґратки |
Тип зв’язку |
лєння, 'C |
піння, •с |
Твер дість |
Крих кість |
“* - — * - · г — провід ність |
ність уводі |
|
NaCl |
||||||||
|
Н,0 |
||||||||
|
SiO2 |
Зробіть висновок щодо залежності фізичних властивостей речовин від структури їх кристалічних ґраток.
ПІДСУМОВУЄМО ВИВЧЕНЕ
• Процес твердіння речовин пов’язаний з упорядкуванням структурних частинок речовини в просторі, утворенням структур, що нагадують ґратки.
• Місця розташування структурних частинок у ґратках називають вузлами.
• Розрізняють три типи кристалічних ґраток: а) молекулярну;
б) йонну; в) атомну.
• У вузлах молекулярної ґратки розташовуються молекули речовин із ковалентним зв’язком, що притягуються дуже слабкими міжмолекулярними силами взаємодії.
• Йонна кристалічна ґратка характерна для речовин із йонним зв'язком. Катіони й аніони розташовуються в шахматному порядку й утримуються силами взаємного притягання.
• Атомна кристалічна ґратка характерна для сполук із ковалентними зв'язками. У вузлах такої ґратки розташовуються атоми.
• Будова речовини та її властивості взаємопов’язані.
ЗАВДАННЯ ДЛЯ САМОКОНТРОЛЮ
1. Поясніть, як ви розумієте процес тверднення речовини.
2. Охарактеризуйте поняття «кристалічна ґратка речовини».
3. Назвіть відомі вам типи кристалічних ґраток.
4. Охарактеризуйте будову: а) молекулярної; б) йонної; в) атомної кристалічних ґраток.
5. Порівняйте властивості речовин із різними типами кристалічних ґраток.
6. Охарактеризуйте взаємоз'язок між будовою і властивостями йонних сполук на прикладі натрій хлориду.
7. Серед переліку речовин, поданих формулами, укажіть речовини з йонною. атомною, молекулярними кристалічними ґратками: N2, H2O1 CaCI2, SiO2. Спрогнозуйте їх властивості.
ЦІКАВО ЗНАТИ
• Алмаз, відомий вам як дорогоцінний ювелірний камінь, маючи атомну кристалічну структуру, отримав широке використання в техніці завдяки своїй твердості.
У годинникарстві він виконує роль опор і підшипників. У металообробній промисловості використовують алмазні свердла й різці для обробки твердих сплавів, фільєри для витягування дроту з металів, ниток спеціальної парашутної тканини. З алмазу виготовляють бури, абразивні матеріали, прилади літаків, човнів, кораблів.
Це матеріал з підручника Хімія 8 клас Савчин
Автор: admin от 18-09-2016, 23:57, Переглядів: 18110