Речовини молекулярної та атомної будови
Матеріал параграфа допоможе вам:
• з'ясувати будову речовин, які складаються з молекул;
• пояснювати фізичні властивості молекулярних речовин;
• зрозуміти будову і фізичні властивості речовин, які складаються з атомів.
Міжмолекулярна взаємодія. Речовина незалежно від її будови може перебувати у трьох агрегатних станах. Твердий і рідкий стани молекулярних речовин існують завдяки тому, що молекули притягуються одна до одної, хоча кожна є незарядженою частинкою. Таке явище називають міжмолекулярною взаємодією.
На відміну від міцних ковалентного та йонного зв’язків, взаємодія між молекулами досить слабка. Вона включає притягання електронів атомів однієї молекули до ядер атомів інших молекул, а в багатьох випадках — ще й взаємне притягання атомів із невеликими протилежними зарядами (§ 16), які належать різним молекулам. Останній вид взаємодії існує, наприклад, у воді, деяких органічних сполуках. Він є важливою умовою для існування живих організмів на нашій планеті.
Фізичні властивості молекулярних речовин. Унаслідок того, що молекули слабко притягуються одна до одної, речовини молекулярної будови істотно відрізняються від йонних речовин за фізичними властивостями. Для молекулярних речовин характерні леткість, низька твердість, невисокі температури плавлення і кипіння. Деякі молекулярні речовини при нагріванні переходять із твердого стану в газуватий, минаючи рідкий. Таке явище називають сублімацією14.

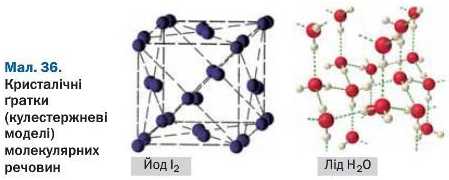
Цю властивість мають, наприклад, йод I2, кар-бон(ІУ) оксид CO2 (мал. 35).
Твердий карбон(1\0 оксид називають «сухим льодом». При підвищенні температури він перетворюється не на рідину; а на газ (вуглекислий), тобто не тане, а випаровується (мал. 35, б). Сухий лід раніше використовували для зберігання морозива.
Звичайний лід за температури, нижчої O °С, також перетворюється на пару, щоправда досить повільно. Завдяки цьому випрана білизна висихає і на морозі.
Чимало молекулярних речовин мають запах. Вам добре відомий різкий запах сульфур(ГУ) оксиду, або сірчистого газу SO2; речовина утворюється при запалюванні сірника (сірка входить до складу його голівки). Газ амоніак NH3 також легко впізнати за запахом. Він виділяється з водного розчину цієї сполуки, відомого під назвою «нашатирний спирт». Не можна сплутати за запахом з іншими речовинами оцтову кислоту CH3COOH, розчин якої (оцет) використовують у домашньому господарстві.
Молекулярні речовини в будь-якому агрегатному стані не проводять електричного струму. (Спробуйте це пояснити.) Багато твердих речовин цього типу утворюють кристали (мал. 36).
Хімічні формули молекулярних речовин указують на склад їхніх молекул. У деяких випадках вони мають кратні індекси. Це стосується, наприклад, формули гідроген пероксиду (пере-
кису водню) H2O2- Графічна формула молекули сполуки:
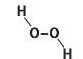
Саме такі молекули (а не НО) містяться в цій речовині. Формулу H2O2, яка показує реальний склад молекули, називають істинною (формула HO є найпростішою). Для більшості молекулярних речовин істинні формули збігаються з найпростішими.
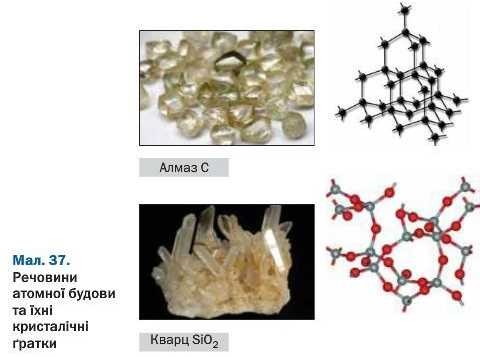
Речовини атомної будови. Існують речовини, у яких усі атоми сполучені один з одним ковалентними зв’язками. Серед них — прості речовини кількох неметалічних елементів (наприклад, бор, графіт, алмаз, силіцій), деякі складні речовини (наприклад, силіцій(ІУ) оксид SiO2).
Кристал речовини, яка складається з атомів, є ніби однією гігантською молекулою (мал. 37). Унаслідок того, що ковалентні зв’язки міцні, речовини атомної будови мають високі температури плавлення і кипіння, практично не розчиняються у воді, інших розчинниках, а деякі вирізняються дуже високою твердістю (алмаз).
Метали складаються зі щільно «упакованих» атомів. їхні зовнішні орбіталі перекриваються, і електрони постійно переходять від одних атомів до інших. Завдяки цьому метали проводять електричний струм і мають інші характерні вла-
стивості. У цих речовинах існує особливий (металічний) зв'язок, який відрізняється від ионного / ковалентного.
ЛАБОРАТОРНИЙ ДОСЛІД № 1 Ознайомлення з фізичними властивостями речовин атомної, молекулярної та йонної будови
Вам видано такі речовини: графіт, сечовина, калій бромід. Вони містяться в посудинах з етикетками. У вашому розпорядженні є пробірки, шпатель, проми-валка з водою, спиртівка або сухе пальне.
Дослідіть поведінку речовин при нагріванні. Що спостерігаєте? На яку будову речовини — атомну чи молекулярну — вказує результат досліду із сечовиною?
Визначте, чи розчиняється кожна речовина у воді.
Заповніть таблицю, у якій укажіть результати проведених експериментів.
|
Характеристика речовин |
Речовини |
||
|
Графіт |
Сечовина |
Калій бромід |
|
|
Будова |
|||
|
Тип хімічного зв’язку |
|||
|
Фізичні властивості: ... |
|||
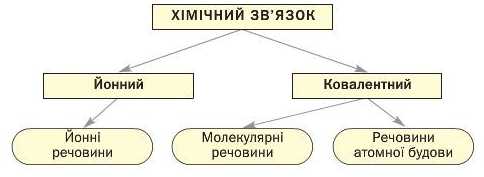
Викладені в цьому і попередніх параграфах відомості про хімічний зв’язок і будову речовин підсумовує схема 5.
Схема 5
Типи хімічного зв’язку і будова речовин
Молекули притягуються одна до одної досить слабко. Тому речовини молекулярної будови мають невисоку твердість, низькі температури плавлення і кипіння, а деякі — запах. Молекулярні речовини не проводять електричного струму.
У речовинах атомної будови всі атоми міцно сполучені між собою. Характерні фізичні властивості таких речовіш — високі температури плавлення і кипіння. Вони не розчиняються у воді, деякі мають дуже високу твердість.
113. Що таке міжмолекулярна взаємодія? Чим вона зумовлена?
114. Сполука X за звичайних умов перебуває у твердому стані, має запах, а за слабкого нагрівання плавиться. Молекулярною чи йонною є ця сполука? Який тип хімічного зв’язку в ній реалізований? До відповіді дайте пояснення.
115. Укажіть у поданому переліку речовини молекулярної будови: парафін, етиловий спирт, калій гідроксид, кальцій оксид, азот, олово, силіцій(ІУ) оксид. Обґрунтуйте свій вибір.
116. Чи можна передбачити будову речовини (йонну, молекулярну, атомну) за її зовнішнім виглядом, агрегатним станом? Відповідь поясніть.
117. Знайдіть відповідність:
Формула речовини Температура плавлення, °С
1) NaH; а) +638;
2) НСІ; 6)-114.
Дайте необхідні пояснення.
118. Спробуйте пояснити, чому прості речовини галогени за звичайних умов перебувають у різних агрегатних станах: фтор F2 і хлор Cl2— гази, бром Br2 — рідина, йод I2 — кристалічна речовина.
119. Хлороводень HCI та фтор F2 мають молекули приблизно однакової маси (підтвердьте це), але істотно різняться за температурами кипіння: -84 0C (HCI) та -187 0C (F2). У чому, на вашу думку, причина такої відмінності?
120. Сполука із формулою SiC має атомні кристалічні гратки. Спрогно-зуйте її фізичні властивості та перевірте ваше передбачення, знайшовши відповідну інформацію в інтернеті.
Домашній експеримент
Дослідження фізичних властивостей речовин із різною будовою
Пропонуємо вам з’ясувати, як будова відомих вам речовин — води, кухонної солі та піску — впливає на їхні фізичні властивості.
Знайдіть в інтернеті або інших джерелах інформації температури плавлення і кипіння кухонної солі (натрій хлориду) та піску (силі-цій(ІУ) оксиду) і запишіть їх у зошит. Додайте до цих відомостей температури замерзання і кипіння води, агрегатний стан речовин за звичайних умов, а також інформацію про те, розчиняється чи не озчиняється У воді сіль, пісок.
Якими частинками — атомами, молекулами, йонами — утворена'1 кожна речовина?
Складіть таблицю і розмістіть у ній зібрану інформацію про властивості речовин та їхню будову.
Зробіть висновок про залежність фізичних властивостей води, кухонної солі та піску від типу частинок, із яких складаються речовини.
Це матеріал з підручника Хімія 8 клас Попель
Автор: admin от 19-09-2016, 01:49, Переглядів: 26829