§ 19. Полярний і неполярний ковалентний зв'язок
Пригадайте, як змінюються металічні та неметалічні властивості елементів, а також радіус атомів у періодах та групах (за § 15).
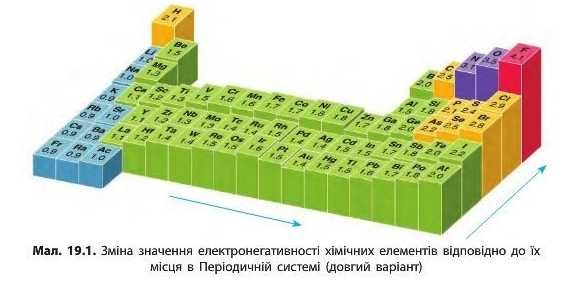
Електронегативність хімічних елементів
Здатність атома притягувати спільні електронні пари називають електронегативністю. Сильніше за всіх притягують електрони атоми найактивніших неметалічних елементів — Флуору, Оксигену, Хлору, адже їм для завершення зовнішнього рівня бракує одного або двох електронів. І електрони, які вони прийматимуть, розташуються досить близько до ядра — на другому або третьому електронному рівні. Тому електронегативність цих елементів найбільша. Легше за всіх віддають електрони атоми активних металічних елементів, у першу чергу лужних — Літію, Натрію, Калію тощо. Вони виявляють найменшу електронегативність.
Оскільки електронегативність — це властивість, яка пов’язана з прийманням та втратою електронів, то і змінюватися вона буде так само, як і неметалічні властивості: у періодах електронегативність посилюється зліва направо, а в групах знизу вгору. Отже, елемент з найбільшою електронегативністю — Флуор, а з найменшою — Францій (мал. 19.1).
Спосіб кількісного визначення електронегативності вперше розробив американський хімік Лайнус Полінг. За шкалою Полінга

Американський хімік і фізик, двічі лауреат Нобелівської премії- З ХІМІЇ R 19S4 р. (зл яивчення природи ХІМІЧНОГО зв'язку) та премія миру в 1962 р. (за боротьбу проти поширення ядерної зброї). Народився в місті Портленд у родині фармацевта. З дитинства цікавився наукою, збирав мінерали і комах. З 13 років виконував досліди з хімії на кухні. У період навчання підробляв миттям посуду та сортуванням паперів. З 1922 р. працював у Каліфорнійському технологічному інституті, де згодом став деканом хімічного факультету. З кінця 60-х років проводив фундаментальні дослідження в Науковому медичному інституті з впливу вітамінів на організм людини і можливості лікування ними ракових захворювань. Ім'я Полінга є серед 20 найвидатніших учених, поряд з Галілеєм, Ньютоном, Дарвіном і Ейнштейном.
електронегативність Флуору прийнята за 3,98 (округлено 4), друге місце за електронегативністю посідає Оксиген (3,44), третє — Хлор (3,16). Гідроген і типові неметалічні елементи розташовані в середині шкали; значення їхніх електронегативностей близькі до 2. Активні металічні елементи мають значення електронегативності менші за 1,6 (див. Додаток 2).
Полярність ковалентного зв'язку
Ковалентний зв’язок може утворитися між однаковими або різними атомами. Атоми різних хімічних елементів мають різну електронегативність, отже по-різному притягують спільну електронну пару. Завдяки цьому для ковалентного зв’язку характерна властивість, що називають полярністю ковалентного зв’язку.
Давайте розглянемо, чим відрізняється хімічний зв’язок у молекулах водню H2, фтору F., та гідроген флуориду HF:
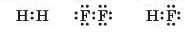
У всіх цих молекулах між атомами утворюється одинарний ковалентний зв’язок завдяки утворенню однієї спільної електронної пари. Ця електронна пара належить обом атомам, між якими існує хімічний зв’язок. Але чи однаковою мірою вона належить обом атомам?
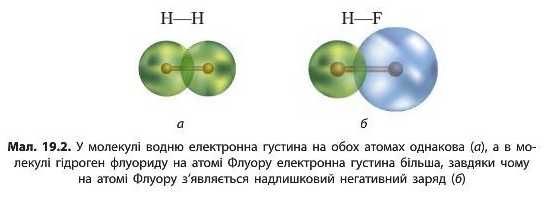
У молекулах фтору і водню спільна електронна пара однаково притягується до обох атомів і належить їм обом однаковою мірою. Такий ковалентний зв'язок називають неполярним. В усіх простих речовинах, утворених неметалічними елементами (наприклад, H2, N2, O2, S.,), хімічні зв’язки неполярні.
У молекулі гідроген флуориду атоми Гідрогену і Флуору притягують електрони по-різному. У Флуору електронегативність більша, ніж у Гідрогену, отже атоми Флуору сильніше притягують спільну електронну пару, ніж атоми Гідрогену. Це призводить до зміщення спільної електронної пари в бік атома Флуору і збільшення на ньому електронної густини (мал. 19.2). Як наслідок, на атомі Флуору з’являється певний надлишковий негативний заряд. На атомі Гідрогену, навпаки, електронна густина зменшується, отже, на ньому з’являється певний позитивний заряд. Схематично це зображають у такий спосіб:
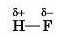
Ковалентний зв’язок, утворений між атомами різних елементів, називається полярним (оскільки в молекулі з’являються полюса
електричного заряду). У ковалентному полярному зв’язку спільна електронна пара зміщена до того атома, який сильніше притягує електрони, тобто до атомів елемента з більшою електронегативністю.
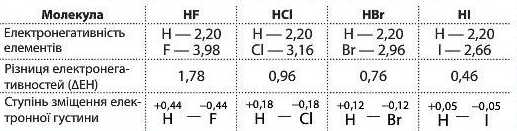
Чим сильніше це зміщення спільної електронної пари, тим більша полярність зв’язку. Так, в ряду галогеноводнів різниця електро-негативностей між Гідрогеном та Флуором значно більша, ніж між Гідрогеном та Йодом. Отже, у зв’язку в гідроген флуориді полярність більша, ніж у гідроген йодиді:
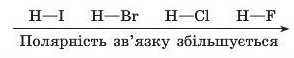
Оскільки електрон, що належав атому Гідрогену, лише частково зміщується у бік атома Флуору, то надлишковий негативний заряд, що з'являється на атомі Флуору, менший за елементарний заряд, тобто менше заряду електрона (-1). У даному випадку він становить лише 44 % від заряду електрона. Щоб не писати точне значення заряду (а в багатьох випадках визначити його досить складно), використовують букву б (дельта). Безсумнівно, що заряд на атомі Гідрогену точно дорівнює заряду на атомі Флуору, але протилежний за знаком, і сума зарядів дорівнює нулю. Тобто молекула залишається електронейтральною. Чим більша різниця електронегативностей двох атомів, тим більший заряд на атомах.
Залежність поляоності зв'язку від електоонегативності елементів
Нітроген — досить активний хімічний елемент, але азот Nj — одна з най-інертніших речовин, яка за інертністю подібна до інертних газів. Азот навіть іноді використовують для створення інертної атмосфери при проведенні хімічних реакцій замість дорожчих аргону або гелію. Це пояснюється надзвичайно міцним зв'язком між атомами Нітрогену в молекулі Nj, що зумовлює його низьку реакційну здатність.
Висновки
1. Полярність ковалентного зв'язку зумовлена різною здатністю атомів притягувати спільні електрони (електронегативністю). Ковалентний зв'язок між однаковими атомами є неполярним, а між різними атомами — полярним.
2. У молекулі на атомі більш електронегативного елемента з'являється надлишковий негативний заряд, а на менш електронегативному атомі — позитивний. Чим більшою є різниця електронегативностей, тим більш полярним є зв'язок.
Контрольні запитання
1. Який ковалентний зв'язок називають неполярним? полярним? Наведіть приклади речовин.
2. Від чого залежить полярність ковалентного зв'язку?
3. Як визначити, на якому з атомів, сполучених ковалентним зв'язком, з'являється негативний заряд, а на якому — позитивний?
4. Яку властивість хімічних елементів називають електронегативністю? Як вона змінюється в періодах і групах? Назвіть найбільш і найменш електронегативні елементи. Відповідь обгрунтуйте.
Завдання для засвоєння матеріалу
1. Випишіть в окремі стовпчики формули речовин з полярним та неполярним зв'язком: SH, NH3, Oj, FjO, Fj, CIF3, P4, NOj, NO, Nj.
2. Запишіть формули речовин у порядку збільшення полярності зв'язку в їх молекулах: HjO, CH4, HF, NHj.
3. Користуючись Додатком 2, обчисліть різницю між електронегативнос-тями елементів у парах: Li-CI, Be—СІ, В-СІ, С-СІ, N-Cl, О—Cl, F-Cl. Укажіть пару елементів з найбільш полярним і найменш полярним зв'язками.
4. Визначивши різницю електронегативностей (див. Додаток 2), укажіть формулу найполярнішої молекули: Hj, НСІ, HF, CIF, Clj, Fj.
5. Серед наведених речовин виберіть сполуки з найбільшою та найменшою полярністю зв'язку: йодоводень НІ, хлороводень НСІ, бромово-день HBr, вода HjO, сірководень HjS, хлор Clj, метан CH4, фосфін PHj.
6. Визначте знак часткового заряду на атомі Хлору в молекулах HCI і CIF. Як ви вважаєте, у якій із цих молекул частковий заряд Хлору більший за абсолютною величиною?
7. Як змінюється в ряду HjO, HjS, HjSe, HjTe полярність зв'язку? Чому?
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:57, Переглядів: 3964