§ 16. Ковалентний зв’язок, його утворення
Опрацювавши параграф, ви дізнаєтеся:
який зв’язок називають ковалентним;
які формули називають електронними;
що таке одинарний, подвійний і потрійний зв'язок.
Під час утворення хімічного зв’язку атоми намагаються набути на зовнішньому енергетичному рівні два або вісім(октет) електронів. Цього можна досягнути декількома способами. Найбільш поширений полягає в об’єднанні неспарених електронів у спільні електронні пари, які належать одночасно обом атомам.
Хімічний зв’язок, який виникає внаслідок утворення спільних електронних пар, називають ковалентним.
Переважна більшість відомих хімічних сполук мають ковалентні зв’язки.
Розглянемо з'творення ковалентного зв’язку в деяких простих молекулах. Електрони зовнішнього енергетичного рівня (валентні електрони) одного атома позначимо крапками, а дрзного — хрестиками, розміщеними збоку, зверхз' чи знизу від символу елемента. Тоді утворення молекули водню H9 можна записати у вигляді схеми:
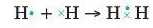
Формулу молекули, у якій вказані валентні електрони всіх атомів, називають електронною формулою. Спільну пару електронів найчастіше позначають рискою, яка і символізує ковалентний хімічний зв’язок, наприклад H - Н. В утвореній молекулі H2 кожному атому Гідрогену належить два електрони, тобто ці атоми мають таку ж електронну конфпурацію, як і атом інертного елемента Гелію.
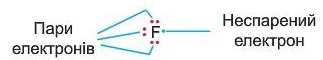
Атоми неметалічних елементів другого періоду намагаються доповнити свою електронну оболонку до октет}'. Складемо схему утворення зв’язку в молекулі фтор}' F2. Атом Флуору має на зов-
нішньому енергетичному рівні сім електронів — три електронні пари і один неспарений електрон:
До завершення зовнішнього рівня атому Флуору не вистачає одного електрона, тому кожний із атомів надає у спільне користування по одному неспареному електрон}':
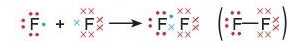
У молекулі фтору F9 кожний атом Флуору має на зовнішньому рівні по вісім електронів (октет), із яких два перебувають у спільному користуванні, а шість (три пари) не беруть участі в утворенні хімічного зв’язку і належать тільки даному атому:

Ковалентний зв’язок може виникати і між атомами різних елементів. У молекулі гідроген флуориду HF атом Гідроген}' за рахунок «чужого» електрона завершує перший енергетичний рівень, а атом Флуору — другий:
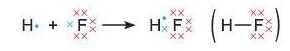
Унаслідок взаємодії двох атомів, кожний із яких має декілька неспарених електронів, утворюються відразу декілька спільних електронних пар. Прикладом є молекула азоту N9. В атомі Нітрогену на зовнішньому рівні п’ять електронів, три із яких неспарені. Саме вони й утворюють три спільні електронні пари. Внаслідок цього кожний атом набуває завершеного зовнішнього енергетичного рівня із восьми електронів (октет):
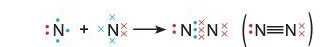
Такий хімічний зв’язок називають потрійним і позначають трьома рисками. Зв’язок, утворений однією парою електронів, називають одинарним, двома парами — подвійним.
Якщо в одному атомі є декілька неспарених електронів, то він може утворювати ковалентні зв’язки одразу із декількома атомами. В молекулі води атом Оксигену утворює два ковалентні зв’язки з двома атомами Гідрогену:
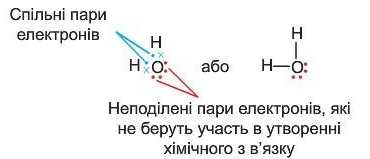
Кожний атом Гідрогену в молекулі води має на зовнішньому рівні по два електрони (спільні з атомом Оксигену), а атом Оксигену — вісім електронів (чотири своїх і дві спільні пари).
Якщо хочете знати хімію глибше...
Зазвичай під час утворення спільної електронної пари кожний із двох атомів надає у спільне користування по одному електрону. У цьому разі вважають, що зв’язок утворений за обмінним механізмом, оскільки атоми обмінюються електронами. Існує й інший варіант утворення ковалентного зв’язку, коли один з атомів надає у спільне користування два електрони, а другий надає для них вільну орбіталь, Атом, який надає електронну пару, називають донором, а атом, який приймає електрони — акцептором. Цей механізм утворення ковалентного зв’язку називають донорно-ак-цепторним.
— ВИСНОВКИ '
Хімічний зв’язок, який виникає внаслідок утворення спільних електронних пар, називають ковалентним.
Зв’язок, утворений однією парою електронів, називають одинарним, двома парами — подвійним, трьома — потрійним.
Структурну формулу молекули, у якій вказані валентні електрони всіх атомів, називають електронною формулою.
Початковий рівень
1. Дайте визначення ковалентного зв’язку.
2. Яку формулу молекули називають електронною?
3. Серед поданих структурних формул
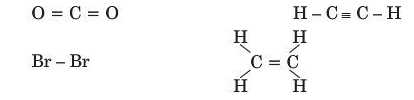
укажіть молекули, які містять: а) одинарний зв язок; б) подвійний зв’язок; в) потрійний зв’язок.
Середній рівень
4. Розгляньте утворення ковалентного зв’язку на прикладі молекули водню.
5. Скільки електронних пар і неспарених електронів містить: а) атом Флуору; б) молекула фтору?
Достатній рівень
6. Наведіть електронну формулу молекули води. Скільки хімічних зв’язків утворює атом Оксигену в цій молекулі?
Високий рівень
7. Зобразіть процес утворення молекул гідроген хлориду НС1, гідроген сульфіду H2S, амоніак}' NH3 з атомів.
,XX · -.XX
8. * Дано три електронні формули: а) X, Yi; б) IZxZ^; в)I Axx Ai.
Які з поданих нижче формул речовин відповідають кожній із них: NH3, НС1, O2, F2, N2, H2, HBr, Cl2?
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:06, Переглядів: 2926