§ 15. Природа хімічного зв’язку.
Електронегативність елементів
Опрацювавши параграф, ви дізнаєтеся:
за яких умов виникає хімічний зв’язок між атомами; що таке електронегативність елементів і як вона змінюється у періодах і групах.
1. Природа хімічного зв’язку
Що примушує атоми сполучатися один з одним? Як пояснити, наприклад, що молекула водню H2 і хлору Cl2 складається із двох атомів, а не трьох, а молекула Гелію He9 не існує? Чому одні атоми сполучаються між собою, а інші — ні? Чому' деякі молекули стійкі, інші легко розпадаються, а треті взагалі ніколи не утворюються ні за яких умов? Відповіді на ці і подібні питання надзвичайно важливі для хіміків.
У XIX ст. було введено поняття валентності як число хімічних зв’язків, які атом утворює з іншими атомами. Наприклад, знаючи, що валентність Гідрогену дорівнює І, а Оксигену — II, можна скласти структурні формули молекул водню, кисню і води:
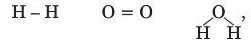
у яких рисками позначені хімічні зв язки між атомами.
Що ж це таке — хімічний зв’язок? Відповісти на це питання вдалося тільки тоді, як було вивчено будову атома. У 1897 р. англійський фізик Дж. Дж. Томсон висловив припущення, що зв’язок має електричну природу і утворюється за рахунок зміщення чи переходу електронів від одного атома до іншого. Ця гіпотеза виявилася правильною.
Атом, як ви вже знаєте, складається із позитивно зарядженого ядра і електронів. Найпростіший атом — атом Гідрогену — має всього один електрон, який міститься на першому енергетичному рівні. Під час зближення двох атомів ядро одного з них притягує електронну хмару іншого і навпаки.
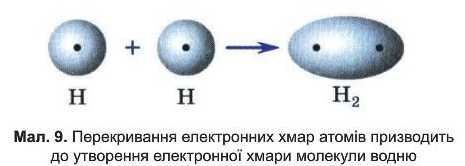
Між атомами виникає взаємодія, і відстань між ними зменшується доти, доки взаємне притягання не урівноважується відштовхуванням між ядрами. В з'твореній молекулі електронна густина в просторі між ядрами є найбільшою. Дві електронні хмари атомів об’єднуються в єдину електронну хмару молекули (мал. 9).
Молекула може утворитися тільки тоді, коли при взаємодії атомів їхня загальна енергія зменшується. Інакше кажучи, утворення хімічного зв’язку завжди супроводжується виділенням енергії, яку називають енергією хімічного зв’язку.
Хімічний зв’язок — це взаємодія атомів або будь-яких інших частинок, що призводить до виникнення стійких утворень — молекул, йонів, кристалів тощо.
Не всі атоми можуть взаємодіяти між собою. Буває так, що при зближенні атомів і перекриванні їхніх електронних хмар молекула не утворюється. Наприклад, якщо два атоми Гелію наближаються один до одного, то загальна енергія весь час збільшується, і молекула He2 утворитися не може.
Умови виникнення хімічного зв’язку визначив американський хімік Г. Льюїс, який у 1916 р. запропонував електрони}' теорію хімічного зв’язку. Ця теорія ґрунтується на уявленні про те, що електронні оболонки атомів інертних елементів мають особливу стійкість, чим і пояснюється їхня хімічна інертність (див. §12). Атоми всіх інших елементів при утворенні хімічного зв’язку намагаються змінити електронну оболонку до конфігурації найближчого інертного елемента, віддаючи чи приєднуючи електрони. Тільки в цьому разі утворюються стійкі молекули. Льюїс назвав це твердження правилом октету (від лат. окто — вісім), оскільки атоми
всіх інертних елементів, крім Гелію, містять на зовнішньому енергетичному рівні вісім електронів.
Тепер зрозуміло, чому утворюється молекула H2, а молекула He2 — ні. Це пояснюється тим, що атому Гідрогену до завершення зовнішнього рівня не вистачає одного електрона. Під час утворення молекули H2 електрони двох атомів об’єднуються, електронна конфігурація кожного атома доповнюється до конфігурації атома Гелію. В той же час в атомі Гелію зовнішній енергетичний рівень уже завершений; його атомам просто не потрібні «чужі» електрони.
2. Електронегативність елементів
З погляду теорії будови атома належність хімічних елементів до металічних чи неметалічних визначається здатністю їхніх атомів віддавати чи приєднувати електрони під час хімічних реакцій.
Властивість атома притягувати валентні електрони інших атомів називають електронегативністю.
Найсильніше притягують електрони атоми типових неметалічних елементів: Флуору, Оксигену, Хлор}', адже їм до завершення зовнішнього енергетичного рівня не вистачає 1 чи 2 електрони. Тому їхня електронегативність найбільша. Як ви пам’ятаєте, найлегше віддають електрони атоми лужних елементів: Літію, Натрію, Калію тощо. Вони мають найменшу електронегативність. За електронегативністю атоми хімічних елементів можна розмістити в ряд, який розпочинається найактивнішими неметалічними елементами і завершується найактивнішими металічними елементами:
F, О, Cl, N, Br, I, S, С, R Н, В, Si, Fe, Cr, Zn, Be, Al, Mg, Ca, Li, Sr, Na, Ba, К, Rb, Cs
Шкалу для визначення електронегативності розробив американський хімік Л. Полінг. За шкалою Полінга електронегативність Флуору дорівнює 4,0, на другому місці — Оксиген, на третьому — Хлор.
Таблиця З
ВІДНОСНА ЕЛЕКТРОНЕГАТИВШСТЬ ДЕЯКИХ ХІМІЧНИХ ЕЛЕМЕНТІВ
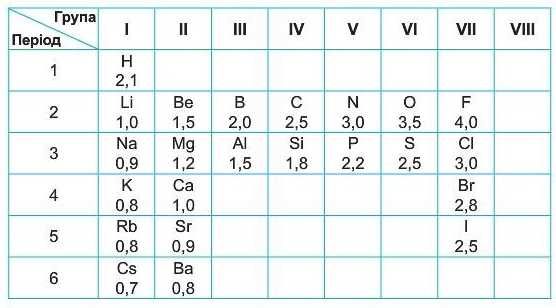
(Числові значення у таблиці дано дуже наближено).
Гідроген і типові неметалічні елементи розміщені всередині шкали; значення їхньої електронегативності близьке до 2. Активні металічні елементи мають значення електронегативності менше, ніж 1,6.
У періодичній системі зміна електронегативності елементів співпадає зі зміною неметалічних властивостей: у періоді зліва направо зростає і зменшується у головній підгрупі зверху донизу.
— ВИСНОВКИ
Сполучення атомів у молекулу супроводжується виділенням енергії. Хімічний зв’язок — це взаємодія атомів або будь-яких інших частинок, що призводить до виникнення стійких утворень — молекул, йонів, кристалів тощо.
Під час утворення хімічного зв’язку атоми намагаються змінити зовнішній енергетичний рівень до октету (восьми електронів), віддаючи і приймаючи електрони або утворюючи спільні електронні пари.
Властивість атома притягувати валентні електрони інших атомів називають електронегативністю.
У періоді електронегативність елементів зліва направо зростає. У головній підгрупі зверху донизу зменшується.
Початковий рівень
1. Чому число відомих молекул у багато разів перевищує число хімічних елементів?
2. Яка елементарна частинка бере участь в утворенні хімічного зв’язку?
3. Що таке електронегативність?
Середній рівень
4. Які сили діють у молекулі водню?
5. Який із лужних елементів має найменшу електронегативність?
6. Який галоген має найбільшу електронегативність?
7. У кожній із формул підкресліть символ елемента, що має найбільшу електронегативність: CaSO1, CO2, FeCl3, NF3, КН, H3PO1, Mg(OH)2.
Достатній рівень
8. Що таке хімічний зв’язок і чому він утворюється?
9. Скільки електронів не вистачає до октету атомам Нітрогену, Хлору, Сульфуру, Карбону?
10. Назвіть найбільш і найменш електронегативні елементи.
Високий рівень
11. Чому одні атоми взаємодіють між собою, а інші — ні?
12. Розмістіть елементи за зростанням їхньої електронегативності:
А) Селен В) Сульфур
Б) Оксиген Г) Телур
13. Розмістіть елементи за зменшенням їхньої електронегативності:
A) Cl Б) Al В) P DSi
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:05, Переглядів: 5666