§ 18. Ковалентний зв'язок
Пригадайте визначення електронних конфігурацій атомів (за § 13).
Утворення ковалентного зв'язку
Ви вже знаєте, що при утворенні хімічного зв’язку атоми прагнуть до того, щоб на їхньому зовнішньому енергетичному рівні було два або вісім (октет) електронів. Цього можна досвіти кількома способами. Один з них полягає в об’єднанні неспарених електронів у спільні електронні пари, що належать одночасно обом атомам. Такий зв’язок називають ковалентним.
Хімічний зв'язок, що виникає в результаті утворення спільних електронних пар, називають ковалентним.
Розглянемо утворення ковалентних зв’язків у деяких простих молекулах. У найпростішому з відомих атомів — атомі Гідрогену — на зовнішньому електронному рівні перебуває один електрон:
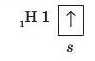
При зображенні утворення хімічного зв’язку прийнято позначати валентні електрони крапкою або хрестиком:
Такі формули називають електронними формулами або електронно-крапковими формулами, або формулами Льюїса. Утворення молекули водню Н, можна записати у вигляді формули:
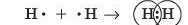
Отже, кожний атом Гідрогену віддає свій валентний електрон у спільне користування. При цьому утворюється спільна електронна пара, що одночасно належить обом атомам Гідрогену. Кожний атом Гідрогену при цьому набуває електронної конфігурації інертного елемента (Гелію), тобто отримує заповнений зовнішній електронний шар, що зумовлює стійкість молекули водню.
Спільну електронну пару, що зумовлює хімічний зв’язок, можна позначити рискою. У такий спосіб складають структурні формули, наприклад, для водню:
H-H
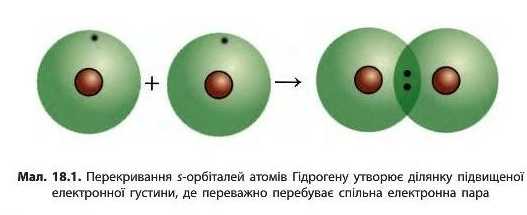
Між атомами Гідрогену утворюється одна спільна електронна пара, тобто один хімічний зв'язок. Такий зв’язок називають ординарним або одинарним. Якщо зобразити утворення спільної електронної пари перекриванням відповідних орбіталей, то вийде молекула, модель якої зображена на малюнку 18.1: дві s-орбіталі атомів Гідрогену перекриваються і в ділянці перекривання утворюється підвищена електронна густина.
Атоми неметалічних елементів другого періоду прагнуть доповнити свою електронну оболонку до октету. Складемо схему утворення зв'язку в молекулі фтору F.,. Атом Флуору містить на зовнішньо-
му рівні сім електронів — три електронні пари й один неспарений електрон:
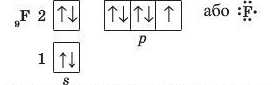
До завершення зовнішнього рівня атому Флуору бракує одного електрона, тому кожний з атомів надає в спільне користування по одному неспареному електрону:
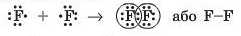
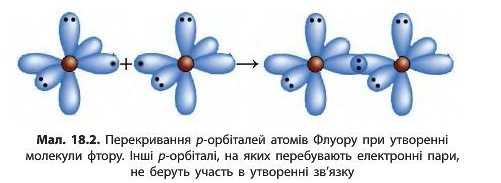
У молекулі фтору F2 атоми Флуору утворюють одну спільну електронну пару шляхом перекривання р-орбіталей (мал. 18.2). У такий спосіб кожний з атомів має на зовнішньому рівні по вісім електронів (октет), з яких два є спільними, а шість (три пари) не беруть участь в утворенні хімічного зв’язку і належать самому атому. Ці три електронні пари називають неподіленнми.
Утворення подвійного і потрійного зв'язків
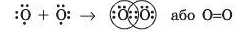
При взаємодії двох атомів, кожний з яких має кілька неспарених електронів, утворюється одночасно кілька спільних електронних пар. Прикладом є молекула кисню 0.,. В атомі Оксигену на зовнішньому рівні шість електронів: дві електронні пари і два неспарені електрони.
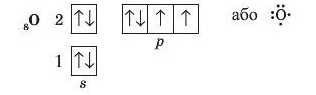
Завдяки цьому кожний атом Оксигену отримує завершений зовнішній енергетичний рівень із восьми електронів (октет). Такий хімічний зв’язок називають подвійним і позначають двома рисками.
Ці неспарені електрони беруть участь в утворенні двох спільних електронних пар:
В атомах Нітрогену на зовнішньому електронному рівні міститься три неспарені електрони:
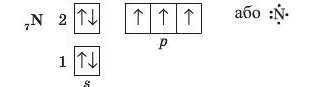
S
Завдяки ним при утворенні молекули азоту N, утворюється три спільні електронні пари:
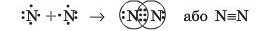
Кожний з атомів Нітрогену отримує завершений зовнішній електронний рівень, що містить октет електронів: шість електронів спільних для обох атомів (три спільні пари) і в кожного з атомів по одній власній електронній парі. Зв’язок у молекулі азоту називають потрійним і позначають трьома рисками.
Утворення зв'язку між різними атомами
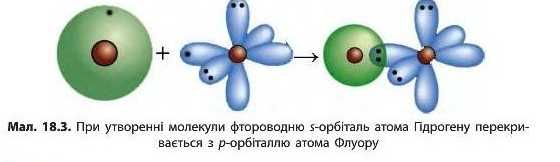
Ми розглянули, як утворюється хімічний зв’язок у молекулах простих речовин, але ковалентний зв’язок може виникнути й між атомами різних елементів. У молекулі гідроген флуориду (фторо-водню) HF атоми за рахунок «чужого» електрона завершують свій зовнішній енергетичний рівень: атом Гідрогену — перший, а атом Флуору — другий (мал. 18.3).
Якщо в одному атомі є декілька неспарених електронів, то він може утворити ковалентні зв’язки одночасно з декількома атомами. У молекулі води Н.,0 атом Оксигену утворює два ординарні ковалентні зв’язки з двома атомами Гідрогену:
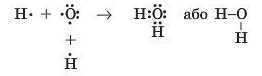
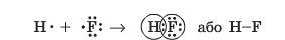
Кожний атом Гідрогену в молекулі води містить на зовнішньому рівні по два електрони (спільні з атомом Оксигену), а атом Оксигену — вісім електронів (чотири свої і дві спільні пари).
Між атомами різних елементів може також утворюватися й подвійний зв’язок, наприклад у молекулі вуглекислого газу CO., між атомами Карбону й Оксигену:
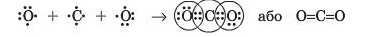
У цьому випадку кожний з атомів Оксигену утворює один подвійний зв’язок, а атом Карбону — два подвійні зв’язки.
Зверніть увагу, що у звичайному стані в атомі Карбону на зовнішньому рівні перебувають тільки два неспарені електрони. Для того щоб утворити чотири хімічні зв'язки, атом Карбону поглинає невелику кількість енергії і переходить у так званий збуджений стан (графічно він позначається зірочкою). Поглинаючи додаткову енергію, один електрон а ς-орбітапі переходить на вільну р-орбіталь і на зовнішньому рівні атома Карбону стає чотири неспарені електрони:
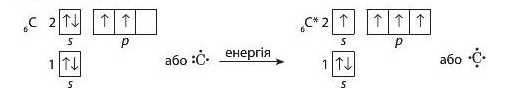
Такий процес досить поширений і відбувається в тих випадках, коли на зовнішньому рівні атомів є вільні орбіталі й електронні пари. Завдяки йому в атомах деяких елементів при поглинанні додаткової енергії у збудженому стані стає більше неспарених електронів, ніж у звичайному (основному стані), і атоми елементів можуть виявляти свою вищу валентність.
Лінгвістично задачо
• Латиною со означає спільний, a vales — той, що має силу. Ґрунтуючись на цьому, поясніть зміст терміна «ковалентний».
• Латиною ordinary означає звичайний. Як ви вважаєте, чому терміни «одинарний зв'язок» та «ординарний зв'язок» є синонімами?
Висновки
1. Ковалентний зв'язок виникає завдяки усуспільненню електронів. При цьому між атомами утворюються спільні електронні пари, що належать обом сполученим атомам. При утворенні ковалентного зв'язку за рахунок неподілених електронних пар та спільних електронів атом набуває електронної конфігурації атома інертного елемента.
2. Зв’язок, що виникає завдяки утворенню однієї спільної електронної пари, є ординарним. Атоми, на зовнішніх електронних рівнях яких є більше одного неспареного електрона, можуть утворювати подвійний зв'язок (дві спільні електронні пари) та потрійний зв'язок (три спільні електронні пари).
3. Атоми деяких елементів, що виявляють змінну валентність, можуть переходити у збуджений стан, утворюючи різні валентні стани завдяки розпарюванню власної електронної пари на вільні орбіталі.
Контрольні запитання
1. Дайте визначення ковалентного зв'язку.
2. Спільна електронна пара — це: а) пара електронів, що належить обом атомам, між якими утворений хімічний зв'язок; б) пара електронів, що не утворює хімічного зв'язку; в) два електрони, що перебувають на одному енергетичному підрівні.
З Які електрони називають неспареними?
4. Яку електронну пару називають неподіленою?
5. Який зв'язок називають: а) ординарним; б) подвійним; в) потрійним? Наведіть приклади молекул з такими зв'язками.
Завдання для засвоєння матеріалу
1. Скільки електронних пар і неспарених електронів містять на зовнішньому енергетичному рівні атоми: а) Хлору; б) Сульфуру; в) Фосфору? Складіть їхні формули Льюїса.
2. Скільки неспарених електронів містить: а) атом Флуору; 6) молекула фтору?
3. Чому не можуть існувати двохатомні молекули інертних елементів?
4. Завдяки електронам якого шару здійснюється зв'язок між атомами: а) у молекулі водню; б) молекулі хлору?
5. Складіть формули Льюїса для молекул хлороводню НСІ, сірководню HjS, амоніаку NH3, метану CH4. Скільки спільних і неподілених електронних пар містять атоми в кожному випадку?
6. Складіть формулу Льюіса для молекули сірки Sj. Скільки електронних пар беруть участь в утворенні ковалентного зв'язку між атомами Суль-фуру? Чи виконується правило октету?
7. Дано три електронні формули: а) X: Y:; б) :Z : Zв) :А ::А:. Які з наведених формул речовин відповідають кожній з них: NH1, НСІ, Oj, F2, Nj, Hj, HBr, CIj?
8*. Складіть графічні електронні формули будови електронної оболонки атома Сульфуру в основному й збудженому станах, щоб на зовнішньому електронному рівні атома було чотири та шість неспарених електронів. Складіть формули Льюіса для сульфур(ІУ) оксиду та сульфур(VI) оксиду.
9*. Складіть графічні електронні формули для електронних оболонок атомів Фосфору та Хлору в основному та різних можливих збуджених станах. Ґрунтуючись на них, поясніть можливі валентності, що можуть виявляти атоми Фосфору та Хлору в сполуках.
10*. Утворення ковалентного зв'язку може відбуватися за обмінним (рекомбінаційним) механізмом, що описаний у цьому параграфі, та за донорно-акцепторним. Знайдіть у додатковій літературі відмінні та спільні риси між цими двома механізмами. Наведіть приклади частинок, при утворенні яких має місце донорно-акцепторний механізм утворення ковалентного зв'язку.
Це матеріал з підручника Хімія 8 клас Григорович
Автор: admin от 13-09-2016, 17:57, Переглядів: 3843