§ 17. Полярний і неполярний ковалентний зв’язок
Опрацювавши параграф, ви дізнаєтеся про:
різновидності ковалентного зв’язку.
1. Полярний і неполярний ковалентний зв’язок
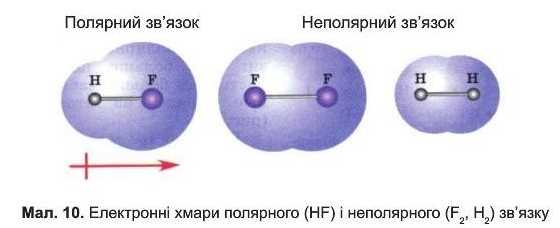
Якщо ковалентний зв’язок утворюється між однаковими атомами, то вони притягують електрони з однаковою силою, і спільна електронна хмара розміщена симетрично відносно обох атомів, тобто електронна пара рівною мірою належить обом атомам. Такий ковапентний зв’язок називають неполярним. У всіх простих речовинах, утворених неметалічними елементами (наприклад, N9, H2, O9, S8), хімічні зв’язки неполярні.
Ковалентний зв’язок, який виникає між атомами різних неметаліч-них елементів, називають полярним. У цьому рай спільна алектронна пара зміщена до тою атома, який сильніше притягує алектрони. Чим сильніше це зміщення, тим більша полярність зв’язку (мол. 10).
Як ви пригадуєте, величину, яка характеризує здатність атома притягувати електрони інших атомів, називають електронега-тивністю.
Порівняємо полярність зв’язку у ряду гідроген галогенідів HF - HCl - HBr - НІ. Флуор — найбільш електронегативний елемент, і він найбільше зміщує спільну електронну пару у свій бік. Тому у сполуці HF полярність зв’язку найбільша. У ряду
F-Cl-Br-I електронегативність зменшується. У молекулі HCl полярність зв’язку менша, ніж у HF, але більша, ніж в HBr і НІ. У молекулі НІ ковалентний зв’язок найменш полярний.
Якщо хочете знати хімію глибше...
2. Полярні молекули
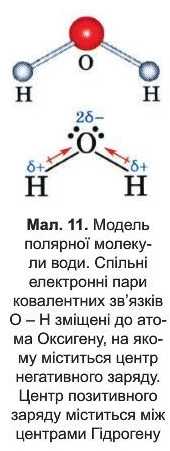
У багатьох молекулах із полярними ковалентними зв’язками центри негативного і позитивного зарядів містяться у різних точках. Таку молекулу називають полярною. Полярні молекули називають диполями. Приклад диполя — молекула води (мал. 11).
Атом, до якого зміщена електронна пара, набуває невеликого негативного заряду, який називають частковим, оскільки він завжди менший за одиницю, і позначається грецькою буквою дельта — δ-. На другому атомі, який бере участь в утворенні зв’язку, виникає рівний за абсолютною величиною частковий позитивний заряд δ+. Значення заряду δ можна вважати мірою полярності зв’язку: чим більша полярність, тим більші часткові заряди на атомах (мал. 12).
Полярність молекули і полярність хімічного зв’язку — різні поняття. Молекула може бути неполярною навіть за наявності полярних зв’язків. Наприклад, у молекулі карбон(ІУ) оксиду атом
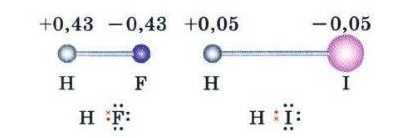
Мал. 12. Моделі сильнополярної молекули HF і слабополярної молекули НІ. Вказані часткові заряди на атомах. В HF спільна електронна пара зміщена сильніше, ніж в НІ
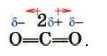
Карбону сполучений з кожним атомом Оксигену двома полярними зв’язками, електронні пари обох зв’язків зміщені від нього до атомів Оксигену:
Проте в цілому' молекула CO9 неполярна, оскільки зв’язки розміщені симетрично відносно центра молекули.
3. Довжина зв'язку
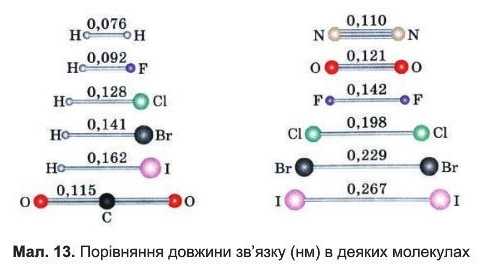
Довжиною зв’язку називають відстань між ядрами сполучених атомів. Атоми зближуються на таку' відстань, на якій перекривання їхніх електронних хмар є найбільшим, а енергія молекули — мінімальною. Довжина зв’язку співмірна із розмірами атомів і звичайно становить 0,1-0,2 нм (1 нм = IO-9 м). Найменша довжина зв’язку в молекулі водню H2 — 0,076 нм (мол. 13), тому' що атом Гідрогену має найменший радіус. Молекулу H9 не можна побачити навіть в електронний мікроскоп.
4. Направленість ковалентного зв’язку
Ковалентний зв’язок утворюється між двома атомами, тобто характеризується направленістю. Якщо один атом у'творює декілька зв’язків, то вони направлені під певними кутами один до одного. Кут між зв’язками (валентний кут) — це кут між лініями, які сполучають центри атомів. Валентні кути в молекулах бувають
різні: від 90 до 180е. Знаючи всі валентні кути і довжину всіх зв’язків, можна визначити геометричну форм}' молекули (мал. 14).

— ВИСНОВКИ
Зв’язок за допомогою пари електронів, яка належить одночасно обом атомам, називається ковалентним. Ковалентний зв’язок між атомами одного і того ж хімічного елемента неполярний, а між атомами різних елементів полярний. Спільна електронна пара полярного зв’язку зміщена в бік більш електронегативного атома.
Початковий рівень
1. Який ковалентний зв’язок називають: а) полярним? б) неполярним?
2. Наведіть приклади сполук із полярним і неполярним ковалентним зв’язком.
Середній рівень
3. Наведіть по одному прикладу молекул з одинарним, подвійним і потрійним зв’язком.
Достатній рівень
4. Запишіть формули речовин у порядку збільшення полярності зв’язку: H2O, CH1, HF, NH3.
Високий рівень
5. Хімічні елементи ГОЛОВНОЇ ПІДГРЗ'ПИ VI групи утворюють з Гідрогеном молекули складу H9E. Як змінюється при збільшенні порядкового номера елемента: полярність зв’язку H - E в цих молекулах?
6. * Які молекули називають диполями?
7. * Випишіть формули молекул-диполів: НС1, Cl2, N9, H9O.
8. * Визначте знак часткового заряду на атомі Хлору в молекулах
HCl і ClE В якій із цих молекул частковий заряд Хлору більший за абсолютною величиною?
9. * Молекула BCl3 має форму рівностороннього трикутника,
у вершинах якого містяться атоми Хлору, а в центрі — атом Бору. Визначте валентний кут у цій молекулі.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:06, Переглядів: 10738