§ 32. Властивості кислот
Опрацювавши параграф, ви:
ознайомитеся із фізичними властивостями кислот; вивчите хімічні властивості кислот;
навчитеся передбачати можливість перебігу реакції між кислотою і металом.
1. Фізичні властивості кислот. Заходи безпеки під час роботи з кислотами
Кислоти мають низькі температури плавлення.
Кислоти можуть бути твердими (H3BO4, H3POf, H9SiO3) або рідкими (H2SO4, HNO3).
Багато кислот є водорозчинними і змішуються з водою у будь-яких співвідношеннях (силікатна кислота H2SiO3 у воді не розчиняється).
Унаслідок розчинення сульфатної кислоти у воді відбувається дуже сильне розігрівання.
Нітратна кислота є леткою (тобто переходить у газуватий стан навіть при невеликому нагріванні). Леткі кислоти мають запах.
Оскільки безоксигенові кислоти є водними розчинами газів (НС1, H2S, НІ тощо), то ці гази виділяються з розчинів навіть за звичайних умов.
Карбонатна і сульфітна кислоти існують лише у водному розчині.
Майже всі неорганічні кислоти — отру'йні речовини, тому під час роботи з кислотами потрібно виявляти максимальну обережність.
При потраплянні розчину кислоти на шкіру слід змити його проточною водою, потім обробити розбавленим розчином соди (щоб знешкодити залишки кислоти) і знову7 добре промити водою.
2. Хімічні властивості кислот
1) Діл на індикатори.
Водні розчини кислот змінюють забарвлення індикаторів: фіолетовий лакмус набуває червоного забарвлення, оранжевий метиловий оранжевий — рожевого, універсальний індикатор набуває червоного забарвлення. Фенолфталеїн залишається безбарвним.
Дія водних розчинів кислот на індикатори
1. У першу пробірку налийте 0,5 мл хлоридної кислоти, у другу — 0,5 мл розчину сульфатної кислоти, у третю — 0,5 мл розчину ортофосфатної кислоти (у пробірці це буде шар висотою приблизно 0,5 см). У кожну пробірку додайте 1-2 краплі розчину лакмусу. Що спостерігаєте?
2. У три порожні пробірки налийте по 0,5 мл хлоридної, сульфатної та ортофосфатної кислот. У кожну пробірку додайте по 1-2 краплі розчину фенолфталеїну. Чи спостерігаєте якісь зміни?
3. У три чисті пробірки налийте по 0,5 мл хлоридної, сульфатної та ортофосфатної кислот. У кожну пробірку додайте по 1-2 краплі розчину метилового оранжевого. Що спостерігаєте?
4. Яким індикатором не можна виявити кислот}'?
5. Вам видані дві пробірки без написів із прозорими розчинами. В одній із пробірок — розчин натрій хлориду, в іншій — хло-ридна кислота. Розпізнайте, у якій із пробірок міститься кислота.
2) Взаємодія з металами.
Характерною властивістю кислот є їх взаємодія з металами:
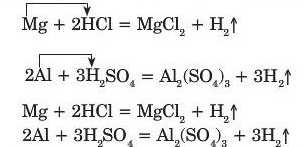
Унаслідок таких реакцій утворюється сіль (як, наприклад, у поданих реакціях магній хлорид MgCl2, алюміній сульфат Al2(SO1)3) і виділяється водень H9. У цих реакціях атоми металічного елемента (Mg, Al) заміщують атоми Гідрогену у молекулі кислоти.
Реакцію між простою і складною речовинами, під час перебігу якої атоми простої речовини заміщують атоми одного з елементів у складній речовині, утворюючи нову просту і нову складну речовину, називають реакцією заміщення.
Проте не всі метали реагують із кислотами так, як у вищенаведених реакціях. Для передбачення можливості перебігу реакції між металом і кислотою користуються рядом активності металів, складеним М.М. Бекетовим на основі багаточисельних дослідів:

Li K Ba Ca Na Mg Al Mn Cr Zn Fe Cd Ni Sn Pb (H2) CuAgPtAu
Метали, розміщені в ряду активності лівіше водню, реагують із кислотами з утворенням солі і виділенням водню. Метали, розміщені правіше водню, або не реагують із кислотами зовсім:
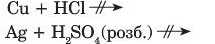
або реагують з утворенням солі та інших продуктів, а водень не виділяється.
Взаємодія хлоридної кислоти з металами
1. Насипте шпателем (або ложкою для сипучих речовин) у чисту пробірку порошок цинку так, щоб прикрити дно пробірки, і долийте 1-2 мл хлоридної кислоти. Що спостерігаєте?
2. Напишіть рівняння хімічної реакції, назвіть продукти реакції.
3. У порожню пробірку помістіть залізні ошурки та додайте 1-2 мл хлоридної кислоти. Опишіть ваші спостереження та напишіть рівняння відповідної хімічної реакції; укажіть назви продуктів реакції.
Насипте порошок магнію, додайте 1-2 мл хлоридної кислоти. Що спостерігаєте? Напишіть рівняння відповідної хімічної реакції; укажіть назви продуктів реакції.
5. У порожню пробірку насипте порошок алюмінію, додайте 1-2 мл хлоридної кислоти. Що спостерігаєте? Напишіть рівняння відповідної хімічної реакції; укажіть назви продуктів реакції.
6. У чисту пробірку помістіть мідні ошурки, долийте 1-2 мл хлоридної кислоти. Чи спостерігаєте якісь зміни?
7. Спостерігайте за інтенсивністю виділення бульбашок водню під час реакцій.
8. Який метал найенергійніше реагує із хлоридною кислотою?
9. Який метал найменш енергійно реагує із хлорид ною кислотою?
10. Який метал не реагує із хлорид ною кислотою?
11. Розмістіть досліджувані метали в ряд за зменшенням активності.
12. Чи відповідає складений вами ряд розміщенню досліджуваних металів у ряді активності металів?
З) Взаємодія з основними оксидами.
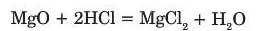
Кислоти взаємодіють з основними оксидами з утворенням солі та води:
Напишіть рівняння реакції між кальцій оксидом і нітратною кислотою.
4) Взаємодія з основами.
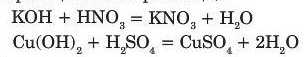
Кислоти реагують з розчинними та нерозчинними основами, в результаті реакцій утворюється сіль і вода. (Пригадайте, що такі реакції називають реакціями нейтралізації).
5) Взаємодія із солями.
Кислоти взаємодіють із солями, якщо:
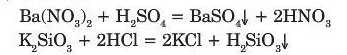
— кислота, яка утворюється внаслідок реакції, є леткою або розкладається з утворенням газу:
— унаслідок реакції утворюється нерозчинна у воді сіль або нерозчинна у воді кислота:
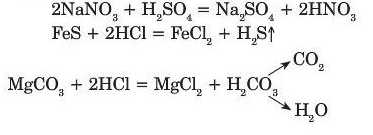
— кислота, що вступає у реакцію, є сильною, а кислота, яка утворюється, слабкою:
До якого типу належать реакції між кислотою і сіллю?
Під час нагрівання оксигеновмісні кислоти розкладаються на воду та кислотний оксид:
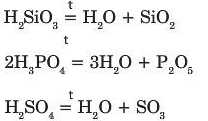
Карбонатна і сульфітна кислоти розкладаються за кімнатної температури:
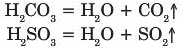
— ВИСНОВКИ
За звичайних умов кислоти перебувають у твердому або рідкому стані, багато кислот розчиняються у воді.
Кислоти змінюють забарвлення індикаторів.
Кислоти реагують з металами, які в ряду активності розміщені лівіше водню, з утворенням солі і води.
Кислоти взаємодіють з основними оксидами, основами і солями.
Оксигеновмісні кислоти розкладаються під час нагрівання.
Початковий рівень
1. Укажіть нерозчинну' у воді кислоту:
A) H2SO4 Б) H2SiO3 В) HNO3 Г) H3PO1
2. Укажіть забарвлення лакмусу у розчині нітратної кислоти:
А) червоне В) жовте
Б) фіолетове Г) синє
3. Укажіть забарвлення метилового оранжевого у розчині орто-фосфатної кислоти:
А) фіолетове В) синє
Б) рожеве Г) малинове
4. Укажіть прізвище вченого, який склав ряд активності металів:
А) М.В. Ломоносов В) Д.І. Менделєєв
Б) М.М. Бекетов Г) О.М. Бутлеров
5. Укажіть газ, який виділяється внаслідок взаємодії металів, розміщених в ряду активності лівіше водню, з кислотами:
А) кисень Б) водень В) азот Г) озон
Середній рівень
6. Внаслідок взаємодії основи і кислоти утворюються
А) основний оксид і вода В) сіль і вода
Б) кислотний оксид і вода Г) сіль і водень
7. Який метал не реагує з розбавленою сульфатною кислотою?
А) залізо Б) алюміній В) цинк Г) ртуть
8. Укажіть речовину, яка реагує із хлоридною кислотою:
А) барій сульфат В) карбоні IV) оксид
Б) барій гідроксид Г) сульфур(УІ) оксид
Достатній рівень
9. У якому варіанті відповіді вказані реакції заміщення?
1) мідь + хлоридна кислота
2) магній + сульфатна кислота
3) магній оксид + хлоридна кислота
4) магній карбонат + нітратна кислота
5) залізо + хлоридна кислота Варіанти відповіді.
А) 1,3 Б) 2,4 В) 3,5 Г) 2,5
10. У якому варіанті відповіді вказано реакції нейтралізації:
1) натрій оксид + хлоридна кислота
2) натрій гідроксид + нітратна кислота
3) калій + сульфатна кислота
4) кальцій оксид + сульфітна кислота
5) ферум(ІН) гідроксид + сульфатна кислота Варіанти відповіді.
А) 1,3 Б) 2,5 В) 2,4 Г) 3,5
11. Допишіть схеми реакцій і складіть хімічні рівняння:
Mg + H2SO4
CaO + HCl NaOH + HNO3 ->
K2O + H3PO4 -Al(OH)3 + HNO3 K2SiO3 + H2SO4'-*
Високий рівень
12. Укажіть відповідність між кількістю речовини кислоти і масою (г) калій гідроксиду, необхідного для повної нейтралізації кислоти:
Кількість Маса (г)
речовини кислоти калій гідроксиду
1) 0,1 моль сульфідної кислоти А) 11,2
2) 0,1 моль нітратної кислоти Б) 44,8
3) 0,2 моль карбонатної кислоти В) 33,6
4) 0,3 моль сульфітної кислоти Г) 22,4
Д) 5,6
13. Укажіть відповідність між масою металу і об’ємом (л, н. у.) водню, який виділиться під час реакції металу з розбавленою сульфатною кислотою:
Маса металу Об'єм (л) водню
1) 2,4 г магнію А) 1,12
2) 5,4 г алюмінію Б) 2,24
3) 26 г цинку В) 6,72
4) 28 г заліза Г) 8,96
Д) И,2
14. У результаті реакції достатньої кількості хлоридної кислоти з 5 г суміші порошків міді і цинку виділилося 0,56 л водню (н. у.). Обчисліть масову частку міді у суміші.
15. Під час взаємодії 7,2 г металу з кислотою виділилося 6,72 л водню. Установіть назву металу, якщо відповідний металічний елемент виявляє у своїх сполуках ступінь окиснення +2,
16. На барій гідроксид подіяли хлоридною кислотою масою 200 г з масовою часткою HCl 7,3%. Обчисліть масу барій хлориду, що утворився в результаті хімічної реакції.
17. На нейтралізацію 10 г розчину з масовою часткою натрій гідроксид}' 10% витрачено 20 г розчин}' нітратної кислоти. Визначте масову частку кислоти у розчині.
18. * Яку масу розчину нітратної кислоти з масовою часткою роз
чиненої речовини 25,2% потрібно затратити на взаємодію із 200 г розчину кальцій гідроксиду з масовою часткою розчиненої речовини 29,6%?
19. * На 8,9 г суміші магнію і цинку подіяли розбавленою сульфат
ною кислотою, узятою у надлишку; унаслідок реакції виділилося 4,48 л водню. Яка масова частка магнію у суміші?
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:18, Переглядів: 4642