§ 31. Властивості основ
Опрацювавши параграф, ви:
дізнаєтеся, як класифікують основи;
вивчите будову, фізичні і хімічні властивості основ.
1. Класифікація основ
Основи поділяють на водорозчинні і нерозчинні у воді. Більшість основ не розчиняється у воді. Малорозчинними є гідроксиди Mg(OH)2, Ca(OH)2 і Sr(OH)2, а добре розчинними — основи, утворені лужними елементами (Li, Na, К, Rb, Cs), і сполука Ba(OH)2- Водорозчинні основи, а також малорозчинний кальцій гідроксид Ca(OH)9 називають лугами.
2. Будова та фізичні властивості основ
Основи — йонні сполуки, у вузлах їхніх кристалічних ґраток містяться катіони металічних елементів Men 1 та гідроксид-аніони. Графічні формули для основ не використовують.
Всі основи — тверді речовини. Деякі мають характерне забарвлення, наприклад Cu(OH)2 — голубого кольору (мол. 44).
Луги — милкі на дотик, роз’їдають шкіру й тканини, тому їх називають їдкими. Якщо розчин лугу потрапив на руку, треба змити його великою кількістю проточної води. Потім, щоб знешкодити залишки лугу, обробити уражене місце розчином оцтової кислоти і знову промити проточною водою.

3. Хімічні властивості лугів
1) Розчини лугів змінюють забарвлення індикаторів. (Пригадайте з курсу 7 класу: які речовини називають індикаторами? Які індикатори ви знаєте?)
У розчинах лугів фіолетовий лакмус набуває синього забарвлення, безбарвний фенолфталеїн — малинового, оранжевий метилоранж — жовтого, універсальний індикатор — синьо-зеленого. Зміна кольору індикатора спричинена наявністю у розчині лугу гідроксид-аніонів OH-. Цю властивість лугів використовують для розпізнавання їх серед інших речовин (мал. 45).
КОЛЬОРИ ІНДИКАТОРІВ У РОЗЧИНАХ КИСЛОТ ІЛУТШ
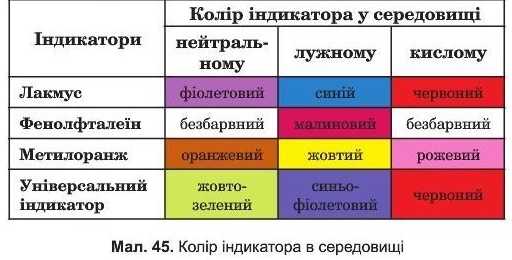
Дія розчинів лугів на індикатори
1. У першу пробірку налийте 0,5 мл розчину натрій гідроксиду, в другу — 0,5 мл розчину кальцій гідроксиду. До обох пробірок додайте по 1-2 краплі розчину лакмусу. Що спостерігаєте?
2. В одну порожню пробірку налийте 0,5 мл розчину натрій гідроксиду, в іншу — 0,5 мл розчину кальцій гідроксиду. До обох пробірок додайте по 1-2 краплі розчину метилового оранжевого. Що спостерігаєте?
3. В одну чисту пробірку налийте 0,5 мл розчину натрій гідроксиду, в іншу — 0,5 мл розчин}' кальцій гідроксиду. До обох пробірок додайте по 1-2 краплі розчину фенолфталеїну. Що спостерігаєте?
4. У першу пробірку налийте 0,5 мл розчину натрій гідроксид}', в другу — 0,5 мл розчину кальцій гідроксид}'. До обох пробірок додайте по 1-2 краплі розчин}' універсального індикатора. Що спостерігаєте?
5. Вам видані дві пробірки без написів із прозорими розчинами. В одній із пробірок — розчин барій гідроксиду, у другій — сульфатна кислота. Використовуючи індикатор, розпізнайте речовини. Опишіть ваші спостереження та зазначте, у якій із пробірок міститься кожна речовина.
2) Луги взаємодіють із кислотами, утворюючи сіль і воду: KOH + HNO3 = KNO3 + H2O
До якого типу — сполучення, обміну чи розкладу — належить реакція між калій гідроксидом і нітратною кислотою?
Запам’ятайте, що
реакції обміну між основою і кислотою називають реакціями нейтралізації.
Взаємодія лугів з кислотами в розчині
1. Налийте у пробірку 1 мл розчину натрій гідроксиду і додайте 1-2 краплі розчину фенолфталеїну. Що спостерігаєте?
2. Додайте у цю ж пробірку 2-3 мл розчину нітратної кислоти. Що спостерігаєте? Напишіть рівняння реакції. Чому розчин у пробірці знебарвився?
3. Декілька крапель розчин}' з пробірки за допомогою піпетки помістіть на предметне скельце, яке затисніть тигельними щипцями, і обережно випарте у полум’ї спиртівки. Що спостерігаєте?
4. Напишіть формулу і назву речовини, кристали якої виявили на предметному склі.
5. У порожню пробірку налийте 1-2 мл розчину барій гідроксиду і 1-2 краплі розчину фенолфталеїну. Що спостерігаєте?
6. У цю ж пробірку додайте 2-3 мл розчин}' сульфатної кислоти. Що спостерігаєте? Поясніть ваші спостереження і напишіть відповідне рівняння хімічної реакції.
7. До якого класу належать продукти взаємодії між лугом і кислотою?
8. До якого типу належать реакції між лугом і кислотою?
3) Луги взаємодіють із кислотними оксидами з утворенням солі і води.
2NaOH + CO2 = Na2CO3 + H2O
4) Луги взаємодіють із розчинними солями, якщо утворена основа або сіль нерозчинні у воді. Ці реа кції відбуваються у розчині:
Ba(OH)2 + Na2SO1 = 2NaOH + BaSO1I 2NaOH + CuCl2 = 2NaCl + Cu(OH)2J,
4. Хімічні властивості нерозчинних основ
1) Нерозчинні у воді основи не .змінюють колір індикаторів.
2) Нерозчинні основи реагують із кислотами, внаслідок реакції утворюються сіль і вода:
Mg(OH)2 + 2НС1 = MgCl2 + 2Н20
3) Нерозчинні основи під час нагрівання розкладаються на оксид металічного елемента і воду:
Cu(OH)2 = CuO + H2O
— ВИСНОВКИ
Луги змінюють забарвлення індикаторів; реагують із кислотами і
кислотними оксидами, з розчинними солями.
Нерозчинні основи не змінюють забарвлення індикаторів; реагують із кислотами, розкладаються під час нагрівання.
Реакції обміну між основою і кислотою називають реакціями нейтралізації.
Початковий рівень
1. Укажіть забарвлення лакмусу у присутності кальцій гідроксиду:
А) червоне В) синє
Б) оранжеве Г) рожеве
2. Укажіть забарвлення фенолфталеїну у присутності натрій гідроксиду:
А) синє В) червоне
Б) фіолетове Г) малинове
3. Укажіть забарвлення метилового оранжевого у присутності барій гідроксиду:
А) жовте Б) рожеве В) малинове Г) оранжеве
4. У якому варіанті відповіді правильно вказано нерозчинні основи:
1) барій гідроксид
2) катій гідроксид
3) KynpjiM(II) гідроксид
4) магній гідроксид
5) натрій гідроксид Варіанти відповіді.
А) 1,2 Б) 3,4 В) 3,5 Г) 2,4
5. Реакція NaOH + HCl -> NaCl + H2O належить до реакцій
А) розкладу В) заміщення
Б) сполучення Г) обміну
6. Реакція Al(OH)3 -* Al2O3 + H2O належить до реакцій
А) розкладу В) заміщення
Б) сполучення Г) обміну
Середній рівень
7. Виберіть речовину, з якою реагує калій гідроксид:
А) алюміній(III) хлорид В) ферум(ІІ) гідроксид
Б) натрій гідроксид Г) магній(И) оксид
8. Виберіть речовину, з якою взаємодіє купрум(ІІ) гідроксид:
А) натрій нітрат В) нітратна кислота
Б) калій силікат Г) барій сульфат
9. Позначте рівняння реакції, що характеризує хімічні властивості нерозчинних основ:
A) MgCl2 + 2NaOH = Mg(OH)2I + 2NaCl Б) Fe(OH)2 = FeO + H2O
B) 2NaOH + SO3 = Na2SO1 + H2O Г) NaOH + HCl = NaCl + H2O
10. Позначте рівняння реакції, яке характеризує хімічні властивості лугів:
A) BaO + SOq = BaSO,
Б) K2O + H2O = 2К0Н
B) Cu(OH)2 = CuO + H2O
Г) Ca(OH)2 + CO2 = CaCO3I+ H2O
11. Укажіть речовину, яка взаємодіє з лугом у розчині:
A) Ca(OH)2 Б) FeCl2 В) MgO Г) H2O
12. Укажіть продукти термічного розкладання магній гідроксид}':
A) Mg і H2O В) MgO і H2
Б) Mg і H2O2 Г) MgO і H2O
13. Проаналізуйте твердження й укажіть, чи є поміж них правильні.
I. Калій гідроксид реагує із KynpjrM(H) сульфатом у розчині з утворенням нерозчинної основи.
II. Калій гідроксид під час нагрівання розкладається на калій оксид і воду.
А) правильне лише І В) обидва правильні
Б) правильне лише II Г) немає правильних
Достатній рівень
14. Напишіть рівняння реакцій між натрій гідроксидом і: а) кар-6oh(IV) оксидом; б) сульфур(УІ) оксидом; в) фосфор(У) оксидом.
15. Напишіть рівняння реакцій між калій гідроксидом і: а) хло-ридною кислотою; б) карбонатною кислотою; в) ортофосфатною кислотою.
16. Напишіть рівняння реакцій між магній гідроксидом і: а) нітратною кислотою; б) сульфатною кислотою.
17. Допишіть схеми реакцій, які відбуваються, і складіть хімічні рівняння:
NaOH + BaCO -*
о
KOH + Na2SO2 Ba(OH)2 + K2SO4 -*
KOH + Fe(NO3)2 -*
Mn(OH)2 + K2CO3 -*
Ni(OH)2 + HNO3 -*
Ba(OH)2 + CaCO3-*
Високий рівень
18. Яку масу купрум(ІІ) сульфату використали для реакції з натрій гідроксидом, якщо внаслідок реакції випало 4,9 г осаду?
19. Обчисліть масу купрум(ІІ) гідроксиду, що утвориться під час взаємодії 4,05 г купрум(ІІ) хлориду з достатньою кількістю калій гідроксиду.
20. Обчисліть об’єм вуглекислого газу (н. у.), необхідний для перетворення 37 г кальцій гідроксиду на кальцій карбонат.
21. " Який об’єм хлоридної кислоти з масовою часткою розчиненої
речовини 16% (густина 1,079 г/см3) потрібно витратити для нейтралізації 50 см3 розчину калій гідроксиду з масовою часткою розчиненої речовини 22% (густина 1,196 г/см3)?
22. * На нейтралізацію 22,7 г суміші калій гідроксиду і барій гід
роксиду витратній 18,9 г нітратної кислоти. Визначте масову частку калій гідроксиду у суміші.
Це матеріал з підручника Хімія 8 клас Дячук
Автор: admin от 12-09-2016, 22:17, Переглядів: 3958