§ 29. Закон фарадея для електролізу
Струм в розчинах електролітів супроводжується виділенням речовини на електродах. Коли негативний іон (аніон) досягає анода, він втрачає надлишкові електрони і перетворюється на нейтральний атом або молекулу. Так само, діставшись катода, позитивний іон (катіон) одержує електрони від катода і перетворюється на нейтральний атом. Струм у розчинах електролітів зумовлює виділення на електродах речовин, яких не було в розчині. Наприклад, процес розчинення мідного купоросу у воді супроводжується дисоціацією молекул CuSO4
на позитивні іони Cu19+ і негативні іони SO4-. Якщо в розчин занурити вугільні електроди, з’єднані з полюсами джерела струму, то катіони Cu19+ будуть рухатися до катода (—), а аніони SO4- до анода (+). Діставшись катода, іони Cu19+ одержують два електрони, перетворюються на нейтральні атоми міді і осідають на катоді. У свою чергу, аніони SO19- віддаючи аноду електрони, перетворюються не нейтральну молекулу, що є нестійкою й розпадається на молекулу SO3 і атом Оксигену О. Кисень виділяється на аноді, а SO3 вступає в реакцію з водою, утворюючи сірчану кислоту. З часом катод вкривається шаром міді, а біля анода виникають пухирці кисню.
Процес виділення речовини на електродах, унаслідок протікання струму в розчинах і розплавах електролітів називають електролізом.
Уперше дослідив процес електролізу англійський вчений Майкл Фарадей (1833—1834 рр.). Зокрема він експериментально встановив, від чого і як залежить маса речовини, що виділяється у процесі електролізу. Сформулюємо закон Фарадея для електролізу.
Маса речовини, яка виділяється на електродах у процесі
електролізу, прямо пропорційна силі струму і часу його протікання.
Увівши позначення: m — маса виділеної речовини; І — сила струму; t — час протікання струму, закон Фарадея для електролізу можна записати так:
m = kit,
де k — коефіцієнт пропорційності. Враховуючи, що добуток сили струму на час його протікання дорівнює заряду q, який пройшов через поперечний переріз провідника за час t (It = q), закон Фарадея набуде вигляду
m = kq.
Маса речовини, що виділилася на електроді, прямо пропорційна заряду, який пройшов через розчин електроліту.
Якщо маса речовини, що відклалася в процесі електролізу за час t, і сила струму в колі відомі, можна визначити коефіцієнт пропорційності k:
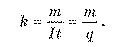
Коефіцієнт пропорційності k називають електрохімічним еквівалентом даної речовини. З останньої формули випливає, що коефіцієнт пропорційності чисельно дорівнює масі речовини, що виділяється на електроді унаслідок перенесення іонами заряду 1 Кл.
Електрохімічні еквіваленти деяких речовин наведено в табл. 2.4.
Таблиця 2.4. Електрохімічні еквіваленти деяких речовин
|
Речовина |
Електрохімічний еквівалент k, мг Кл |
Речовина |
Електрохімічний еквівалент k, мг Кл |
|
Алюміній (Al3+) |
0,093 |
Натрій (Na1+) |
0,238 |
|
Гідроген (H+) |
0,010 |
Нікель (Ni2+) |
0,304 |
|
Залізо (Fe3+) |
0,193 |
Срібло (Ag1+) |
1,118 |
|
Золото (Au3+) |
0,681 |
Хлор (Cl1) |
0,367 |
|
Оксиген (O2) |
0,083 |
Хром (Cr3+) |
0,180 |
|
Мідь (Cu2+) |
0,330 |
Цинк (Zn2+) |
0,339 |
ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Яке явище називають електролізом?
2. Сформулюйте закон Фарадея для електролізу?
3. Що таке електрохімічний еквівалент речовини?
4. Дві однакові електролітичні ванни (А і В) наповнили розчинами мідного купоросу. Концентрація розчину у ванні А більша, ніж у ванні В. У якій з ванн виділиться більше міді, якщо їх з’єднати послідовно? Паралельно?
5. Яка маса міді виділиться на електроді під час електролізу мідного купоросу за 10 хв сили струму 2 А?
6. Скільки часу тривало нікелювання, якщо у процесі електро-_ лізу на виробі осів шар нікелю масою 3,6 г за сили струму 2 А?
7. Електролітичні ванни, в одній з яких була сіль нікелю, а в іншій — хрому, з’єднали послідовно і пропустили струм. Після розмикання кола виявилося, що в одній ванні виділилося 10 г нікелю. Скільки грамів хрому виділилося у другій ванні за той самий час?
8. Скільки електроенергії необхідно для одержання 1 т алюмінію і скільки часу триватиме цей процес, якщо електроліз відбувається за напруги 5 В і силі струму 40 кА?
9*. Скільки часу має тривати електроліз для покриття виробу, площа якого 500 см2, шаром хрому товщиною 50 мкм за сили струму 100 А? Густина хрому становить 7200 кг/м3.
ЗАСТОСУВАННЯ ЕЛЕКТРОЛІЗУ
Явище електролізу широко застосовують у техніці на виробництві для одержання чистих кольорових металів, виготовлення скульптур і барельєфів, захисту виробів від корозії та ін.
Одержання кольорових металів. Однією з галузей застосування електролізу є одержання чистих металів. Мідні руди містять сірчисті сполуки міді, її окисли, а також домішки сторонніх металів (Ni, Pb, Sb, As тощо). Видобуту з руди мідь, в якій є багато домішок, відливають у вигляді пластин. Ці пластини завантажують у електролітичні ванни з розчином мідного купоросу CuSO4. Вони відіграють роль анодів. Як катоди між ними розміщують тонкі пластини чис-
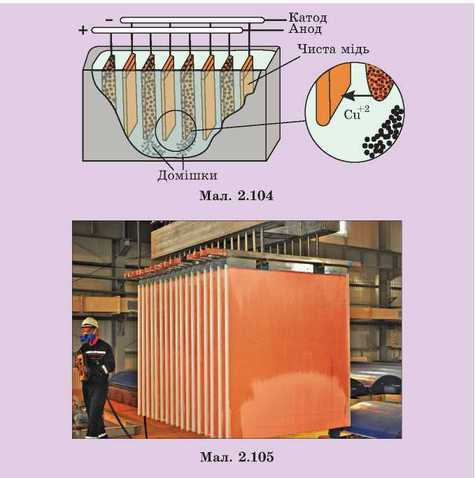
тої міді. Добираючи певну напругу на електродах ванни, домагаються, щоб на катоді виділялася тільки металева мідь. При цьому анодні пластини з домішками розчиняються. Сторонні домішки або переходять у розчин (не виділяючись на катоді), або випадають на дно ванни у вигляді осаду. Такий спосіб одержання чистих металів називають електролітичним рафінуванням. Схематично ванна для рафінування міді показана на мал. 2.104. На мал. 2.105 зображено вивантаження пластини чистої міді після рафінування.
Одержання металів з розплавів за допомогою електролізу є винятково важливим для кольорової металургії. Добувати метали електролізом можна не тільки з водних розчи-
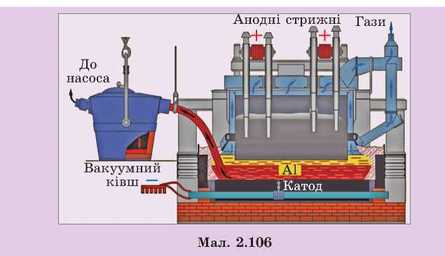
нів, а й з розплавів речовин, які в твердому стані складаються з іонів (наприклад, NaCl). При плавленні їх іони набувають потрібної рухливості. Так, з розплаву бокситів добувають увесь алюміній.
Електроліз проводять у сталевих електролітичних те-плоізольованих і обкладених вогнетривкою цеглою ваннах. Усередині електролітичну ванну викладено графітовими блоками. Останні разом з розплавленим алюмінієм є катодом. Аноди — це вугільні стрижні, змонтовані так, щоб вони могли опускатися в міру їхнього згоряння (мал. 2.106). Алюміній одержують електролізом розчину Al2O3 у розплавленому кріоліті. Процес відбувається за температури близько 1000 °С. На аноді виділяється кисень, а на катоді — алюміній. Алюміній збирається на дні печі, звідки періодично випускається.
Гальваностегія. За допомогою електролізу металеві вироби, виготовлені з одного металу, можна вкрити шаром іншого. Такий процес називають гальваностегія. Гальваностегію використовують, щоб уберегти металеві вироби, які швидко іржавіють в атмосферному повітрі (піддаються корозії), або для зміцнення поверхні виробу. У таких випадках електролітичним способом покривають вироби металами, які не окислюються: нікелем, хромом, цинком та ін. Для надання гарного вигляду виконують сріблення та золочення.
Перед покриттям іншим металом виріб старанно очищають, знежирюють і занурюють у електролітичну ванну з розчином солі того металу, яким мають покрити виріб. Як електроліт можна використовувати, наприклад, сіль нікелю. До виробу приєднують негативний полюс джерела струму, тому виріб стає катодом. Як анод використовують пластину, виготовлену з нікелю. У процесі електролізу на виріб осідає тонкий шар нікелю (мал. 2.107).
Гальванопластика. Понад 100 років тому російський вчений Б.С. Якобі (1801 —1874 рр.) винайшов спосіб електролітичного одержання копій з металу. Цей спосіб назвали гальванопластика. У процесі електролізу мідь або інший метал точно відтворюють форму предмета, на яку їх осаджують. Гальванопластика широко використовується для виготовлення різноманітних барельєфів та скульптур. У процесі електролізу метал осаджують товстим шаром (до кількох міліметрів) на форму. Коли товщина металевого шару досягне кількох міліметрів, його відокремлюють від форми.
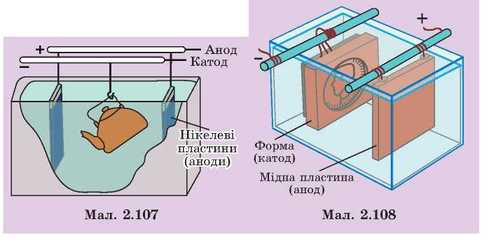
Форми для нанесення металу можна виготовляти з металу або й з матеріалів, що не проводять електричний струм: з гіпсу, воску, пластмаси, дерева і навіть пластиліну. Готові форми обов’язково вкривають струмопровідним шаром. Для цього на поверхню форми наносять тонким шаром порошок графіту або бронзи. Форму, вкриту струмопровідним шаром, використовують як катод. Якщо виріб має бути з міді, форму занурюють в розчин мідного купоросу. Як анод застосовують мідну пластину (мал. 2.108).
Після того, як на поверхню форми осяде достатньої товщини шар міді, електроліз припиняють, і одержану металеву деталь від’єднують від форми. Вона точно відображує всі елементи форми. Гальванопластика дає змогу виготовляти порожнисті фігури і статуї. Це робить їх легшими і сприяє економії цінних металів.
ЗАПИТАННЯ ТА ЗАВДАННЯ
1. Як застосовують електроліз для одержання чистих металів?
2. Для чого використовують гальваностегію?
3. Опишіть в загальному технологію покриття металевих виробів, виготовлених з одних металів, іншими металами.
4. Що таке гальванопластика?
5. Чому форми для одержання барельєфів, виготовлені з непровідних матеріалів, вкривають шаром графіту або бронзового порошку?
Це матеріал з Підручника Фізика 8 Клас Бойко
Автор: evg от 7-08-2016, 20:58, Переглядів: 11981